
编者按:
抑郁症已成为一种非常普遍的疾病,影响着人类健康和社会经济。近期我们在国外媒体上看到不少学术和产业界对抑郁症相关饮食和营养干预的关注,以及精神益生菌等一些营养补充剂的研发。
今天我们特别编译了 2018 年 11 月 17 日发表在 Clinical Nutrition 期刊上的一篇综述,这篇有关抑郁症的饮食建议的综述是欧盟 FP7 资助的 MyNewGut 项目,由爱尔兰科克大学 APC 微生物组研究所 Ted Dinan 教授牵头,对饮食、情绪和微生物之间的关系进行了研究。
希望本文能够对学术和产业界人士有一定的参考价值,对关注抑郁症的读者也有一定的科普意义。
以下是《热心肠日报》对本文的简要解读:
饮食与抑郁症的关系
Clinical Nutrition ——[IF:6.402]
① 先天缺陷和后天压力等多种因素会协同导致抑郁,抑制促炎因子或兴奋下丘脑-垂体-肾上腺轴是治疗抑郁的关键机制;② 饮食经肠道菌群的代谢产物可通过肠神经系统、免疫系统或血液循环直接或间接影响大脑,进而影响抑郁,但其因果关系尚不明确;③ 地中海饮食结构(膳食富含水果、蔬菜、五谷杂粮)可增加肠道微生物多样性,有助于减轻抑郁症状;④ 抑郁症患者应主要摄入富含谷物和膳食纤维的饮食,限制摄入精制糖类同时配合适当的运动保健。
Feeding melancholic microbes: MyNewGut recommendations on diet and mood
2018-11-17, doi: 10.1016/j.clnu.2018.11.010
【主编评语】抑郁症是一种非常普遍的疾病,在所有欧洲国家都会产生重大的经济影响。现在有大量证据支持肠道微生物对中枢神经化学和行为的影响,特别是压力相关的疾病,如抑郁症。最近的研究表明抑郁症患者有肠道生态失调。这种生态失调的原因尚不确定。已有证据表明地中海饮食的人抑郁率较低,因此应鼓励患有抑郁症或易患抑郁症的患者加强含有高含量谷物/纤维和鱼类的植物性饮食。(@玉龙潭)
饮食与抑郁症的关系:MyNewGut项目对饮食和情绪的建议
Feeding melancholic microbes:
MyNewGut recommendations on diet and mood
作者|Dinan TG等
编译|董丽娜
校审|617
在欧洲,抑郁症发病率逐年升高并造成了巨大的经济负担。目前认为,脑-肠-微生物轴是了解和治疗这一疾病的新方向。已有大量的证据支持肠道菌群对中枢神经系统的化学物质和神经通路异常,尤其是压力反应具有重要的影响。最近的研究显示,抑郁症患者存在肠道菌群失调但失调的原因尚不清楚。
近几十年来,欧洲和其它地区的饮食模式发生了很大的改变——饮食中红肉、高脂食物,以及精糖摄入量明显增加。地中海饮食人群的抑郁症发病率较低,最新的研究显示地中海饮食可能含有抗抑郁的成分。那么,地中海饮食中哪些成分介导了这种效应呢?高水平的多酚或多不饱和脂肪酸备受关注。
MyNewGut 推荐抑郁症患者或有抑郁倾向的人群加强植物性饮食,增加全谷物、膳食纤维和鱼类的摄取。
背景
抑郁症不仅是精神疾病中的“普通感冒”,更是一种普遍存在的疾病。在欧洲,抑郁症的花费占到了精神和神经疾病总花费的三分之一1。
情绪性障碍有多种表现形式,其中主要包括单相抑郁和双相情感障碍(以前称为躁郁症)。在欧洲,重度抑郁发病率在 3%至 6%之间,所有社会阶层都不能避免该疾病2。尽管我们主要关注于抑郁的生物学研究,但实际上它仍然是一个综合征3,它的确诊是通过一系列的症状而不是客观的实验检查。

尽管不是所有的抑郁症都是由社会心理压力下的负面生活事件所诱发,但是多数情况下,遗传和早期生活的不良事件容易引发该疾病。抑郁的核心特征为情绪低落、缺乏快感和丧失感受快乐的能力。尽管焦虑可以被归为另一类疾病,但它是大多数抑郁的一个常见重要特征,一般表现为焦虑综合征、惊恐症或者强迫症。
在欧洲及其它国家,当前治疗重度抑郁的药物主要作用于单胺系统(儿茶酚胺和血清素系统)4。但这些药物的局限性在于起效慢且有高达 40% 的患者对治疗无反应5。
心理疗法单独使用或者是联合药物使用同样具有局限性。认知行为治疗(CBT)和正念治疗是最广泛应用和研究的心理治疗方法6。对于许多患者,抗抑郁药物联合认知行为或正念治疗是最佳的治疗方式。
在过去的几十年,炎症在抑郁症的病理生理学中的作用及确诊的抑郁症易感性备受关注。已证实多数抑郁与促炎因子 IL1、IL8 和 TNF-α 增加相关7。这些炎症因子有效地激活了下丘脑-垂体-肾上腺轴(HPA),且在维持抑郁症患者的 HPA 过度激活中可能具有重要的作用8。任何形式的抑郁症治疗方法都伴随着促炎细胞因子的抑制和 HPA 活化程度的降低9。
有趣的是,从营养角度来看,与标准的北欧饮食相比,地中海饮食被认为具有抗炎效应且与较低的抑郁发病率相关10。
FP7 EU MyNewGut 项目,是一个为期五年的研究项目(2013-2018年),它是一个跨学科综合性项目,旨在解开我们的肠道微生态之谜,研究微生态与生活方式因素的互作(如饮食、饮食习惯、压力等),对肥胖和行为异常的调节通路的影响。
本综述对饮食和情绪的关系以及微生物在其中如何发挥效应进行了总结。
精神健康新模式脑-肠-微生物轴作为新提出的模式备受关注,不仅仅在神经科学领域尤其是精神健康相关领域具有重要意义,而且被认为是一个潜在的分水岭11。不断增加的证据支持肠道菌群对中枢神经系统的化学物质和神经通路异常,尤其是压力反应具有重要的影响12。且有人的功能核磁13和脑电图14研究支持了动物研究结论。
那么,肠道菌群通过什么机制发挥重要的中枢效应,且如何通过饮食靶向干预脑-肠-微生物轴,从而为抑郁症患者带来有效的治疗效应呢?
回顾现有的脑-肠-微生物轴和精神健康相关研究文献,这些研究最大的不足在于缺乏良好的设计及足够有力的临床研究证据。正如早前所指出的那样,迄今发表的大多数文献来自临床前的研究11。仅从动物实验中就得出主要的临床结论是存在一定问题的 (图 1)。
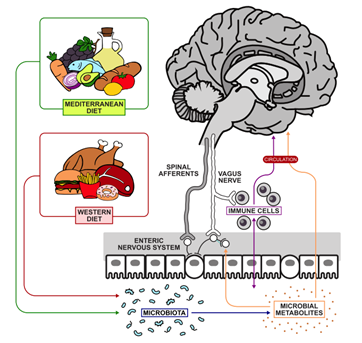
图1. 肠道微生物与大脑之间的交流途径:饮食对肠道微生物组成具有调控作用
脑-肠-微生物互作
有人提出肠道微生物与大脑的交流是一个黑盒子,因为我们对它的理解非常有限。然而,这可能是对当前知识领域的一个过度悲观的分析15。我们知道脑-肠-微生物是一个双向交流的系统,这个系统不仅能够使肠道微生物与脑进行交流,而且脑反过来也可以与肠道交流16。
多年来人们一直在研究脑肠交互作用,但是近年来才提出肠道微生物是肠脑交流的重要媒介。信号转导的机制非常复杂,包括神经、内分泌、免疫和代谢通路。
临床前的动物研究显示,迷走神经,这一长而蜿蜒的神经,是外周肠道微生物和中枢介导的行为效应之间交流的基本神经通路。在迷走神经干切断术后,鼠李糖乳杆菌(JB1)的中枢效应被消除证实了这一点17。
流行病学研究显示,全迷走神经干切除术治疗消化道溃疡能够降低患帕金森病的风险18。肠道菌群还通过改变前体水平调节脑的单胺,如血清素的释放。例如长双歧杆菌 35624 被认为能够增加血浆的色氨酸水平并影响中枢的 5-羟色胺19。色氨酸是血清素的前体氨基酸而人脑储存能力有限,因此需要不断的从外周摄入。色氨酸来源于食物及肠道双歧杆菌的合成。

有趣的是,很多肠道细菌能够合成和释放神经介质。乳杆菌和双歧杆菌属能够产生 γ-氨基丁酸(GABA);埃希氏菌属、芽孢杆菌属和酵母菌能够产生去甲肾上腺素;念珠菌、链球菌属、埃希氏菌属和肠球菌属能够产生五羟色胺;芽孢杆菌能够产生多巴胺;乳杆菌能够产生乙酰胆碱20、21。
这些肠道来源的神经递质能通过肠道的黏膜屏障,但它们不太可能直接影响脑化学反应,因为即使它们进入血液循环,也不可能通过血脑屏障。所以他们对脑功能的影响极有可能是通过激活局部的肠神经系统而发挥作用。
短链脂肪酸包括丁酸、丙酸和乙酸,是肠道菌群活性代谢产物而且是丰富的能量来源。它们也可能通过 G 蛋白偶联受体(GPCRs)发挥中枢效应,然而这些 GPCRs 在哺乳动物脑内分布分散,且这些短链脂肪酸在血浆中半衰期很短。另一种可能是,它们可通过抑制组蛋白去乙酰化酶 (HDACs)调控表观遗传22。
另一个肠脑交流通路是免疫系统,它通过细胞因子信号发挥作用23。这些分子在肠道保持特定水平并能够通过血流运输到脑。
然而,正常的生理循环下它们不能通过血脑屏障,但是有越来越多的证据发现这些信号分子在血脑屏障处发出信号,从而影响血脑屏障缺乏的脑区,如下丘脑室旁核和脑室周围器官发。感染或其它情况造成血浆的细胞因子如 IL1 和 IL6 水平升高,从而激活人体重要应激系统如下丘脑-垂体-肾上腺轴,从引起皮质醇释放。这是压力应激系统激活最可能的机制,与在干扰素治疗肝炎或黑色素瘤时出现的抑郁等疾病具有一定的相关24。
精神疾病和肠道菌群失调
越来越多的证据表明,一些精神疾病比如抑郁等与肠道菌群失调相关。抑郁的病理生理原因仍未被完全阐明,某种程度上讲菌群失调是其重要环节。
当前的研究仅证明了抑郁和菌群改变的相关性,需要进一步在反复发作的抑郁患者中设计严谨的前瞻性研究以揭示因果关系。
抑郁症
Lyte 等25发现使用亚临床剂量的致病空肠弯曲杆菌给小鼠灌胃并没有产生免疫应答,但是可以导致小鼠出现焦虑样行为。该研究还发现脑干某些区域,如核束孤和臂旁外侧核在灌胃导致的自主神经内分泌和行为反应中发挥作用。
最近发表的流行病学分析也为肠道感染和焦虑之间的关系提供了证据。Bruch 根据 MEPS(Medical Expenditure Panel Survey)的调查数据进行了肠道感染和焦虑失调的前瞻性研究26。研究数据纳入了 18 岁及以上没有焦虑综合征的人,有 2577 个受试者纳入时有肠道感染,最终 4239 人出现焦虑障碍。总的来说,肠道感染与随后出现的焦虑障碍显著增加相关。这一重要的流行病学研究为肠道感染和焦虑发生的关联提供了有力的证据。
O'Mahony 及其团队成员研究了母婴分离抑郁大鼠模型的肠道菌群变化27。他们报道这些动物中皮质酮增加、促炎因子增加、菌群多样性降低。
最近的一项研究通过对抑郁症患者的粪便菌群测序的方法开展研究28。该研究招募了 46 个抑郁症患者和 30 个健康对照,高通量测序显示抑郁症患者发作时菌群多样性降低,但是治疗有效组中菌群多样性并未增加,表明多样性降低是抑郁症的一种状态而不是标志。

这项研究中,抑郁症患者的拟杆菌门、变形菌门和放线菌门增加而厚壁菌门显著降低。尽管个体间差异较大,但多种优势菌属水平在抑郁症患者和健康人之间存在显著差异。抑郁症患者的肠杆菌科和另枝菌属增加,而费氏杆菌属降低。作者认为必须进一步研究阐明抑郁症和肠道菌群的因果关系,以便评估肠道微生物作为标志物的适用性。
爱尔兰 APC 微生物组研究所的一项研究显示,抑郁症患者皮质醇增加伴随粪便微生物多样性降低,令人惊讶的是,给予小鼠来自抑郁症患者与健康对照组的微生物,抑郁症患者的微生物诱发小鼠在行为和免疫上出现抑郁表型29。
抑郁症伴随其他疾病
抑郁症常常伴随多种其它的医学症状,包括心血管疾病、代谢综合征以及消化道症状比如肠易激综合征(IBS)。
IBS 是一类表现为腹痛或者不适并且排便习惯会发生改变,但没有明显组织病理学或生化病理改变的疾病。IBS 患者血浆中的促炎因子增加30,并伴有肠屏障功能异常31。
肠屏障功能异常被认为可以导致“肠漏”,造成革兰氏阴性菌的脂多糖(LPS)等炎症分子进入血流32,随后激活 Toll 样受体(TLR)相关的免疫系统。母婴分离的 IBS 动物模型也表明肠道微生态改变常伴有促炎因子改变25。
饮食和微生物
低质量的饮食会改变抑郁症患者的肠道微生物。饮食多样性降低导致必需营养物质减少,而这些必需营养物质缺乏会引起特定微生物缺乏生长底物,从而引起抑郁症患者的肠道菌群失调。
过去的几十年,在欧洲和其它地方的饮食模式在饮食结构上发生了很大的改变,红肉、高脂食物以及精糖摄入大量增加。这些西式饮食和久坐的生活方式导致了肠道菌群的改变,这某种程度上促进了慢性炎症性相关疾病,比如心血管疾病、肥胖、炎症性肠病以及抑郁等疾病的发病率升高33。
如果我们希望改善食物的营养价值并对精神健康产生积极影响,我们需要更加全面的理解食物与微生态之间的生物学相互作用。

许多人群的研究已经评估了饮食对肠道菌群的影响,但是由于很难控制生活方式等潜在的混杂变量,因而具有非常大的局限性。
另一个局限性在于,微生物组样本主要是粪便样本,而粪便样本很难提供不同肠道区域的微生物的详细信息。
但我们仍然需要基于这些局限性去更好地分析饮食模式和微生物组之间的关系。
地中海饮食和抑郁症
越来越多的证据支持低质量的饮食是重度抑郁的一个风险因素。长期以来的流行病学研究证实地中海饮食地区抑郁症的发病率低34。饮食中富含水果、蔬菜、谷物以及鱼类似乎对抑郁具有保护作用,而精加工食物和高糖食品更容易导致抑郁35。
然而,这些结论多来自观察性研究得出的数据,缺乏相应的控制对照研究。地中海饮食的积极作用可能通过肠微生态脑轴介导发挥作用,目前尚未被完全证实。
最新一项澳大利亚的研究中,使用随机对照实验设计评估饮食对重度抑郁症患者治疗的有效性36。在控制社会条件等混杂因素后,使用结构化的饮食来研究改良后的地中海饮食的治疗作用。
招募了 67 个患者,这些患者诊断为重度抑郁而且评分在 75 及以上,评分超过 104 的被剔除,并使用饮食筛查工具(Dietary Screening Tool)对低质量饮食进行评分。如果患者正在抗抑郁药物治疗或者心理治疗,他们需要在纳入前进行至少两周同样的治疗。12 周后,饮食干预组抑郁评分较对照组得到显著改善。
总的来说,这个实验结果提示,改善饮食可能是一种有用的抑郁治疗方法,至少它是一个常规治疗的有效辅助手段。
Forsyth 及其团队的另一项研究得到相似的结论37。此外,原来越多的证据发现饮食通过改变肠道微生态而影响健康38、39。
如果地中海饮食真的可以预防或者可能治疗抑郁症,那么这些饮食中是什么成分发挥这样的效应呢?
多不饱和脂肪酸和情绪
脑是一个富含脂质的器官包含许多复杂的极性磷脂、鞘脂、神经节苷脂和胆固醇,这些物质与神经元的形态学和生理学密切相关40。
脑中的甘油磷脂富含多不饱和脂肪酸(PUFA),多不饱和脂肪酸主要来源于必需脂肪酸、亚油酸和 a-亚油酸。
脑中多不饱和脂肪酸主要包括 Ω-3 脂肪酸衍生的二十二碳六烯酸(DHA)、Ω-6 脂肪酸和亚油酸衍生的 α -亚油酸、花生四烯酸和二十二碳四烯酸41。
Ω-3 脂肪酸来自鱼油,而且有流行病学证据支持那些吃鱼较多的人患心血管疾病的概率较低42。如今,Ω-3 脂肪酸对抑郁症的影响成为关注的焦点。研究显示,在鱼类消费量较高的国家,抑郁症的发病率较低43。然而,在许多欧洲国家,近几十年来 Ω-3 PUFA 的摄入量随着 Ω-6 PUFA 的增加而下降44。
Hibbeln 是最早揭示 Ω-3 不饱和脂肪酸在精神健康中具有重要性的人之一:在一项跨国研究中他发现全世界范围内的鱼类消费量和抑郁症患病率之间存在显著的负相关45。随后的研究发现在抑郁症患者血浆中 Ω-6/Ω-3 比例改变46,红细胞的磷脂也发生了变化47。尸解发现抑郁症患者脑组织的前额脑区底部 DHA 水平较低。

Nemets 及其团队成员对 22 例抗抑郁治疗无反应的抑郁症患者进行研究48。通过设置平行组、双盲设计研究在持续的抗抑郁治疗中添加 EPA(二十碳五烯酸)或安慰剂的作用。3 周治疗后,Ω-3 组较安慰组治疗效应显著。
Peet 等在 70 例患者中研究 EPA 对抑郁症的抗抑郁作用49。患者接受抗抑郁治疗同时随机接受安慰剂或者 EPA,剂量为每天 1、2、4 克,疗程 12 周。52 例 EPA 治疗患者中的 46 例完成了 12 周实验,18 例安慰剂治疗患者中的 14 例完成了 12 周实验,研究显示每天 1 克组较安慰剂组有显著较好的预后。因此作者提出每天 1g EPA 是解决抗抑郁治疗抵抗的有效方法。
但是,DHA 的结果无法确定。36 例患有重度抑郁的患者接受了为期 6 周的DHA(2g/d)治疗,Montgomery-Asberg 抑郁量表的得分显示,与安慰剂组间没有差异50。大量没有设置合适对照组的开放性研究报道 DHA 有益,但是这些缺乏安慰剂对照的研究结果需要谨慎看待51。
最新的一项 meta 分析对使用 Ω-3 PUFAs 单独治疗或者辅助治疗的 15 项试验(共计 916 例参与者)进行分析。不论是否有其它共发症,只要抑郁症是主要症状,或者使用适合的指标评估抑郁情绪,则选择前瞻的、随机的和双盲、安慰剂对照的研究设计52。
这项 meta 分析显示,n-3 PUFA(200-2200 mg/d DHA)中联合 >60% 的 EPA 能够改善临床状况。然而,仅有 DHA 或者 <60% EPA 对于原发性抑郁症没有效果。
EPA 具有抑制炎症的能力,能起到广泛的免疫抑制效应。这可能与治疗抑郁相关,普遍认为抑郁症急性期 C 反应蛋白和促炎细胞因子的增加相关。一项最新的研究显示多不饱和脂肪酸通过增加双歧杆菌丰度而影响肠-脑轴53。从这点上讲似乎推荐抑郁症患者吃鱼更合理,但没有足够的证据支持 Ω-3 PUFAs 可用作单独或辅助抑郁症的治疗。
益生菌和抑郁症
长期以来认为发酵食品有益健康,近年来逐渐认识到发酵食品对精神健康也有益处。
已经有许多关于益生菌治疗作用的观点,但是大多数未被严格的安慰剂对照实验证实。精神益生菌是指那些摄入足够的量细菌能够对精神健康有益的细菌54。
益生菌治疗胃肠道失调 IBS 已非常普遍。一些安慰剂为对照的研究表明,双歧杆菌治疗是有效的55。或许这是因为高达 40%的 IBS 患者并发抑郁症,而很多双歧杆菌具有抗炎活性。使用益生菌治疗重度抑郁的主要机制在于它们抑制了抑郁相关促炎分子。
益生菌或精神益生菌是否能够改变异常的免疫?IBS 中双歧杆菌使得促炎转变至抑炎以恢复免疫平衡56。研究发现双歧杆菌治疗有效者中抗炎因子 IL10增加,促炎因子 IL12 降低。嗜酸乳杆菌也有类似发现报道57。
一些抑郁症动物模型用于药物开发。母婴分离模型中长双歧杆菌 35624 能够使动物行为正常化19并且降低了皮质醇水平。这可能表明特定的双歧杆菌菌株具有抗抑郁的活性。
最近的一项研究,Benton 团队使用安慰剂对照设计来评估益生菌对健康人群的情绪的影响。132 个健康人(平均年龄为 62 岁)被招募,每天摄入含有益生菌或者安慰剂的牛奶,为期 3 周58。对基线期以及 10 天和 20 天治疗后的情绪进行评估,发现益生菌组中起初情绪很差的人在研究结束时获得改善,而安慰剂组未见这种改善。

这些发现是否能够转化为临床应用尚未有研究。
有研究评估了鼠李糖乳杆菌 HN001 对妊娠及产后母亲抑郁和焦虑的缓解效应59。212 名妇女随机分为 HN001 组和以 211 为对照的安慰剂组。服用HN001 显著降低妇女产后期抑郁和焦虑评分。这是迄今为止文献报道的最好的人群干预的研究,这些结果为精神益生菌具有产后抑郁保护作用提供有力证据。
总的来说,迫切需要开展精神益生菌在抑郁患者中作用的研究。
纤维和抑郁症
益生元是可以增加好的益生菌如双歧杆菌并被微生物代谢的纤维。在蔬菜里比如芹菜、洋姜、大蒜等中发现了益生元。大量的小型临床实验已经发现特定的益生元对心理预后有效。
Schmidt 团队研究显示,补充能够刺激双歧杆菌生长的益生元低聚半乳糖(GOS)3 周后,可显著降低健康志愿者清醒时的皮质醇水平,而皮质醇是一种压力应激激素且与焦虑和抑郁密切相关60。
相比较安慰剂组,B-GOS 人群通过降低对负面信息的敏感性,并获取大量正面信息来改变行为预后。有趣的是,补充低聚果糖(FOS)并没有效果。这些结果提示,通过益生元的摄入来重塑菌群能够影响行为预后。在人中,补充反式 GOS 益生元不仅能够增强双歧杆菌的生长还能够改善腹胀症状,而且有显著降低 IBS 患者焦虑评分的作用61。

高纤维饮食可以减少抑郁症状,饮食中总纤维素含量较高(每天 27 克以上)、大量蔬菜摄入和大量全谷物摄入分别降低了 42%、46%及 41%的抑郁症出现的可能性62。
在一项美国成人的研究中显示,摄入大量的全谷类与抑郁评分降低相关63。同样,一项日本妇女的横断面研究显示,全谷物摄入和抑郁评分显著负相关64。
与上述饮食相反的饮食如高糖的摄入可增加抑郁症的发病率65。
多酚
众所周知,多酚是植物中最多的一类植物素,它们大致被分为黄酮类和非黄酮类。
红酒中的白藜芦醇被发现具有强有力的中枢神经系统激活作用。在动物抑郁症模型中,白藜芦醇可显著降低抑郁行为,同时降低皮质醇和促炎因子的释放66。此外,它还可通过去乙酰化酶 Sirtuins 发挥抗氧化活性,微生物可以代谢 Sirtuins 并影响肠道拟杆菌和厚壁菌门的比例67。但迄今为止,还没有白藜芦醇在抑郁症患者中的控制性实验被发表。

多酚自然产物姜黄素可以发挥许多生物和药理作用。与安慰剂组相比,姜黄素能够降低抑郁症患者唾液的皮质醇水平68。最近的数据表明它可以显著增加肠道菌群的多样性69。
蛋白来源
传统的地中海饮食对红肉摄入适度,而大量摄入红肉会产生促炎效应。最近的肉类饮食的 meta 分析发现,较高抑郁症风险与肉类的摄入有关70。高加工的肉具有特定的负面效应71(图 2)。

图2. 对精神健康有益的食物金字塔
My New Gut 团队建议
地中海饮食与抑郁的发生率低相关,这或许与对肠道微生态有益的影响有关,且越来越多的证据表明这样的饮食具有抗抑郁的效应。
建议抑郁症患者或者有抑郁倾向的人选择富含全谷物和纤维的食物;建议减少红肉尤其是精加工肉的摄入,限制精制糖的摄入,并定期摄入鱼类和发酵食品;建议进行与年龄和身体健康相适的有氧锻炼,这样做不仅具有控制体重的作用,还有很多更为广泛的益处72。
原文:DOI:10.1016/j.clnu.2018.11.010
参考文献
-
[1]Andlin-Sobocki P, Jonsson B, Wittchen HU, Olesen J. Cost of disorders of thebrain in Europe. Eur J Neurol 2005;12(Suppl. 1):1e27.
-
[2] RatheeshA, Davey C, Hetrick S, Alvarez-Jimenez M, Voutier C, Bechdolf A, et al.Asystematic review and meta-analysis of prospective transition from majordepression to bipolar disorder. Acta Psychiatr Scand 2017;135(4):273e84.
-
[3] KendlerKS. DSM disorders and their criteria: how should they inter-relate? Psychol Med2017;47(12):2054e60.
-
[4] Sharma H,Santra S, Dutta A. Triple reuptake inhibitors as potential next generationantidepressants: a new hope? Future Med Chem 2015;7(17):2385e406.
-
[5] Korte SM,Prins J, Krajnc AM, Hendriksen H, Oosting RS, Westphal KG, et al.The manydifferent faces of major depression: it is time for personalized medicine. EurJ Pharmacol 2015;753:88e104.
-
[6] Parikh SV,Segal ZV, Grigoriadis S, Ravindran AV, Kennedy SH, Lam RW, et al.CanadianNetwork for Mood and Anxiety Treatments (CANMAT) clinical guidelines for themanagement of major depressive disorder in adults. II.Psychotherapy alone or incombination with antidepressant medication.J Affect Disord 2009;117(Suppl.1):S15e25.
-
[7] LeonardBE. Inflammation and depression: a causal or coincidental link to thepathophysiology? Acta Neuropsychiatr 2017:1e16.
-
[8] Chopra K,Kumar B, Kuhad A. Pathobiological targets of depression. ExpertOpin TherTargets 2011;15(4):379e400.
-
[9] LeonardBE. Inflammation and depression: a causal or coincidental link to thepathophysiology? Acta Neuropsychiatr 2018;30(1):1e16.
-
[10] MilaneschiY, Bandinelli S, Penninx BW, Vogelzangs N, Corsi AM, Lauretani F,et al.Depressive symptoms and inflammation increase in a prospective study of olderadults: a protective effect of a healthy (Mediterranean-style) diet.MolPsychiatry 2011;16(6):589e90.
-
[11] Dinan TG,Cryan JF. Brain-gut-microbiota Axis and mental health. PsychosomMed2017;79(8):920e6.
-
[12] Dinan TG,Cryan JF. Gut instincts: microbiota as a key regulator of brain development,ageing and neurodegeneration. J Physiol 2017;595(2):489e503.
-
[13] TillischK, Labus J, Kilpatrick L, Jiang Z, Stains J, Ebrat B, et al. Consumption offermented milk product with probiotic modulates brain activity. Gastroenterology2013;144(7):1394e401. 401 e1-4.
-
[14] Allen AP,Hutch W, Borre YE, Kennedy PJ, Temko A, Boylan G, et al. Bifidobacterium longum1714 as a translational psychobiotic: modulation of stress, electrophysiologyand neurocognition in healthy volunteers. Transl Psychiatry2016;6(11):e939.
-
[15] Dinan TG,Cryan JF, Stanton C. Gut microbes and brain development have black boxconnectivity. Biol Psychiatry 2018;83(2):97e9.
-
[16] Rhee SH,Pothoulakis C, Mayer EA. Principles and clinical implications of thebrain-gut-enteric microbiota axis. Nat Rev Gastroenterol Hepatol2009;6(5):306e14.
-
[17] Bravo JA,Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al.Ingestion ofLactobacillus strain regulates emotional behavior and central GABA receptorexpression in a mouse via the vagus nerve. Proc Natl Acad SciU S A2011;108(38):16050e5.
-
[18] SvenssonE, Horvath-Puho E, Thomsen RW, Djurhuus JC, Pedersen L,Borghammer P, et al.Vagotomy and subsequent risk of Parkinson's disease. Ann Neurol2015;78(4):522e9.
-
[19] DesbonnetL, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probioticBifidobacterium infantis in the maternal separation model of depression.Neuroscience 2010;170(4):1179e88.
-
[20] Lyte M.Microbial endocrinology in the microbiome-gut-brain axis: how bacterialproduction and utilization of neurochemicals influence behavior. PLoS Pathog2013;9(11), e1003726.
-
[21] Lyte M.Microbial endocrinology and the microbiota-gut-brain axis. Adv ExpMed Biol2014;817:3e24.
-
[22] StillingRM, Dinan TG, Cryan JF. Microbial genes, brain & behaviour e epigeneticregulation of the gut-brain axis. Genes Brain Behav 2014;13(1):69e86.
-
[23] El AidyS, Dinan TG, Cryan JF. Immune modulation of the brain-gut-microbe axis. Front Microbiol2014;5:146.
-
[24] CapuronL, Hauser P, Hinze-Selch D, Miller AH, Neveu PJ. Treatment of cytokine-induceddepression. Brain Behav Immun 2002;16(5):575e80.
-
[25] Lyte M,Varcoe JJ, Bailey MT. Anxiogenic effect of subclinical bacterial infection inmice in the absence of overt immune activation. Physiol Behav 1998;65(1):63e8.
-
[26] Bruch JD.Intestinal infection associated with future onset of an anxiety disorder: resultsof a nationally representative study. Brain Behav Immun 2016;57:222e6.
-
[27] O'MahonySM, Marchesi JR, Scully P, Codling C, Ceolho AM, Quigley EM, et al. Early lifestress alters behavior, immunity, and microbiota in rats: implications forirritable bowel syndrome and psychiatric illnesses. BiolPsychiatry2009;65(3):263e7.
-
[28] Jiang H,Ling Z, Zhang Y, Mao H, Ma Z, Yin Y, et al. Altered fecal microbiota compositionin patients with major depressive disorder. Brain Behav Immun2015;48:186e94.
-
[29] Kelly JR,Borre Y, O'Brien C, Patterson E, El Aidy S, Deane J, et al. Transferring the blues:depression-associated gut microbiota induces neurobehavioural changes in therat. J Psychiatr Res 2016;82:109e18.
-
[30] Dinan TG,Quigley EM, Ahmed SM, Scully P, O'Brien S, O'Mahony L, et al.Hypothalamic-pituitary-gut axis dysregulation in irritable bowel syndrome:plasma cytokines as a potential biomarker? Gastroenterology 2006;130(2):304e11.
-
[31]Bashashati M, Rezaei N, Shafieyoun A, McKernan DP, Chang L, Ohman L, etal.Cytokine imbalance in irritable bowel syndrome: a systematic review and meta-analysis.Neuro Gastroenterol Motil e Offic J Eur Gastrointest MotilSoc2014;26(7):1036e48.
-
[32] MoloneyRD, Desbonnet L, Clarke G, Dinan TG, Cryan JF. The microbiome: stress, healthand disease. Mamm Genome 2014;25(1e2):49e74.
-
[33] GallandL. Diet and inflammation. Nutr Clin Pract 2010;25(6):634e40.
-
[34]Sanchez-Villegas A, Henriquez P, Bes-Rastrollo M, Doreste J. Mediterranean dietand depression. Public Health Nutr 2006;9(8A):1104e9.
-
[35] AkbaralyTN, Brunner EJ, Ferrie JE, Marmot MG, Kivimaki M, Singh-Manoux A.Dietarypattern and depressive symptoms in middle age. Br JPsychiatry2009;195(5):408e13.
-
[36] O'Neil A,Berk M, Itsiopoulos C, Castle D, Opie R, Pizzinga J, et al. A randomised, controlledtrial of a dietary intervention for adults with major depression (the“SMILES”trial): study protocol. BMC Psychiatry 2013;13:114.
-
[37] ForsythA, Deane FP, Williams P. A lifestyle intervention for primary care patientswith depression and anxiety: a randomised controlled trial. Psychiatry Res2015;230(2):537e44.
-
[38] DeFilippis F, Pellegrini N, Vannini L, Jeffery IB, La Storia A, Laghi L, et al.High level adherence to a Mediterranean diet beneficially impacts the gutmicrobiota and associated metabolome. Gut 2016;65(11):1812e21.
-
[39] Haro C,Garcia-Carpintero S, Rangel-Zuniga OA, Alcala-Diaz JF, Landa BB,Clemente JC, etal. Consumption of two healthy dietary patterns restored microbiota dysbiosisin obese patients with metabolic dysfunction. Mol NutrFood Res 2017;61(12).
-
[40] O'BrienJS, Sampson EL. Lipid composition of the normal human brain: gray matter, whitematter, and myelin. J Lipid Res 1965;6(4):537e44.
-
[41] Haag M.Essential fatty acids and the brain. Can J Psychiatry 2003;48(3):195e203.
-
[42] Sakai C,Ishida M, Ohba H, Yamashita H, Uchida H, Yoshizumi M, et al. Fish oilomega-3polyunsaturated fatty acids attenuate oxidative stress-induced DNA damage invascular endothelial cells. PloS One 2017;12(11), e0187934.
-
[43] Li F, LiuX, Zhang D. Fish consumption and risk of depression: a meta-analysis. J EpidemiolCommunity Health 2016;70(3):299e304.
-
[44]Simopoulos AP. Essential fatty acids in health and chronic disease. Am JClinNutr 1999;70(3 Suppl):560Se9S.
-
[45] HibbelnJR. Fish consumption and major depression. Lancet 1998;351(9110):1213.
-
[46] Dinan T, SigginsL, Scully P, O'Brien S, Ross P, Stanton C. Investigating the inflammatoryphenotype of major depression: focus on cytokines and polyunsaturated fattyacids. J Psychiatr Res 2009;43(4):471e6.
-
[47] Peet M,Murphy B, Shay J, Horrobin D. Depletion of omega-3 fatty acid levels in redblood cell membranes of depressive patients. Biol Psychiatry1998;43(5):315e9.
-
[48] Nemets B,Stahl Z, Belmaker RH. Addition of omega-3 fatty acid to maintenance medicationtreatment for recurrent unipolar depressive disorder. Am JPsychiatry2002;159(3):477e9.
-
[49] Peet M,Horrobin DF. A dose-ranging study of the effects of ethyleicosapentaenoate inpatients with ongoing depression despite apparently adequate treatment withstandard drugs. Arch Gen Psychiatry 2002;59(10):913e9.
-
[50] MarangellLB, Martinez JM, Zboyan HA, Kertz B, Kim HF, Puryear LJ. A doubleblind,placebo-controlled study of the omega-3 fatty acid docosahexaenoic acid in thetreatment of major depression. Am J Psychiatry 2003;160(5):996e8.
-
[51] Smith DJ,Sarris J, Dowling N, O'Connor M, Ng CH. Adjunctive low-dose docosahexaenoicacid (DHA) for major depression: an open-label pilot trial. NutrNeurosci2017:1e5.
-
[52] SubletteME, Ellis SP, Geant AL, Mann JJ. Meta-analysis of the effects ofeicosapentaenoic acid (EPA) in clinical trials in depression. J ClinPsychiatry2011;72(12):1577e84.
-
[53]Costantini L, Molinari R, Farinon B, Merendino N. Impact of omega-3 fatty acidson the gut microbiota. Int J Mol Sci 2017;18(12).
-
[54] Dinan TG,Stanton C, Cryan JF. Psychobiotics: a novel class of psychotropic. BiolPsychiatry 2013;74(10):720e6.
-
[55] QuigleyEMM. The gut-brain Axis and the microbiome: clues to pathophysiology andopportunities for novel management strategies in irritable bowel syndrome(IBS). J Clin Med 2018;7(1).
-
[56] O'MahonyL, McCarthy J, Kelly P, Hurley G, Luo F, Chen K, et al. Lactobacillus andbifidobacterium in irritable bowel syndrome: symptom responses and relationshipto cytokine profiles. Gastroenterology 2005;128(3):541e51.
-
[57] Torii A,Torii S, Fujiwara S, Tanaka H, Inagaki N, Nagai H. Lactobacillus Acidophilusstrain L-92 regulates the production of Th1 cytokine as well as Th2cytokines.Allergol Int e Offic J Jpn Soc Allergol 2007;56(3):293e301.
-
[58] Benton D,Williams C, Brown A. Impact of consuming a milk drink containing a probiotic onmood and cognition. Eur J Clin Nutr 2007;61(3):355e61.
-
[59] SlykermanRF, Hood F, Wickens K, Thompson JMD, Barthow C, Murphy R, et al.Effect ofLactobacillus rhamnosus HN001 in pregnancy on postpartum symptoms of depressionand anxiety: a randomised double-blind placebo controlled trial. EBioMedicine2017;24:159e65.
-
[60] SchmidtK, Cowen PJ, Harmer CJ, Tzortzis G, Errington S, Burnet PW. Prebiotic intakereduces the waking cortisol response and alters emotional bias in healthyvolunteers. Psychopharmacology (Berl) 2015;232(10):1793e801.
-
[61] Silk DB,Davis A, Vulevic J, Tzortzis G, Gibson GR. Clinical trial: the effects ofatrans-galactooligosaccharide prebiotic on faecal microbiota and symptomsinirritable bowel syndrome. Aliment Pharmacol Ther 2009;29(5):508e18.
-
[62] GopinathB, Flood VM, Burlutksy G, Louie JC, Mitchell P. Association between carbohydratenutrition and prevalence of depressive symptoms in older adults. Br J Nutr2016;116(12):2109e14.
-
[63] Kim WK, ShinD, Song WO. Are dietary patterns associated with depression in U.S. Adults? JMed Food 2016;19(11):1074e84.
-
[64] Sakai H,Murakami K, Kobayashi S, Suga H, Sasaki S. Three-generation Study of Women onD, et al. Food-based diet quality score in relation to depressive symptoms inyoung and middle-aged Japanese women. Br J Nutr2017;117(12):1674e81.
-
[65] GangwischJE, Hale L, Garcia L, Malaspina D, Opler MG, Payne ME, et al. High glycemicindex diet as a risk factor for depression: analyses from the Women's HealthInitiative. Am J Clin Nutr 2015;102(2):454e63.
-
[66] Yang XH,Song SQ, Xu Y. Resveratrol ameliorates chronic unpredictable mild stress-induceddepression-like behavior: involvement of the HPA axis, inflammatory markers,BDNF, and Wnt/beta-catenin pathway in rats. Neuropsychiatric Dis Treat2017;13:2727e36.
-
[67] Bird JK,Raederstorff D, Weber P, Steinert RE. Cardiovascular and antiobesity effects ofresveratrol mediated through the gut microbiota. Adv Nutr2017;8(6):839e49.
-
[68] Yu JJ,Pei LB, Zhang Y, Wen ZY, Yang JL. Chronic supplementation of curcumin enhancesthe efficacy of antidepressants in major depressive disorder: a randomized,double-blind, placebo-controlled pilot study. J Clin Psychopharmacol2015;35(4):406e10.
-
[69] Zhang Z,Chen Y, Xiang L, Wang Z, Xiao GG, Hu J. Effect of curcumin on the diversity ofgut microbiota in ovariectomized rats. Nutrients2017;9(10).
-
[70] Zhang Y,Yang Y, Xie MS, Ding X, Li H, Liu ZC, et al. Is meat consumption associatedwith depression? A meta-analysis of observational studies. BMCPsychiatry2017;17(1):409.
-
[71] Oddy WH,Allen KL, Trapp GSA, Ambrosini GL, Black LJ, Huang RC, et al. Dietary patterns,body mass index and inflammation: pathways to depression and mental healthproblems in adolescents. Brain Behav Immun 2018;69:428e39.
-
[72] Stubbs B,Vancampfort D, Firth J, Schuch FB, Hallgren M, Smith L, et al. Relationshipbetween sedentary behavior and depression: a mediation analysis of influentialfactors across the lifespan among 42,469 people in low-and middle-incomecountries. J Affect Disord 2018;229:231e8.













