编者按:
近期的研究表明,肠道菌群可以调节机体的情绪、认知、记忆等,并且与焦虑抑郁、孤独症、阿尔茨海默病等神经疾病存在密切关联。那么肠道菌群是如何影响肠道与大脑之间的交流呢?
今天,我们特别关注 Cell 杂志发布的“SnapShot: The microbiota-gut-brain axis”。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
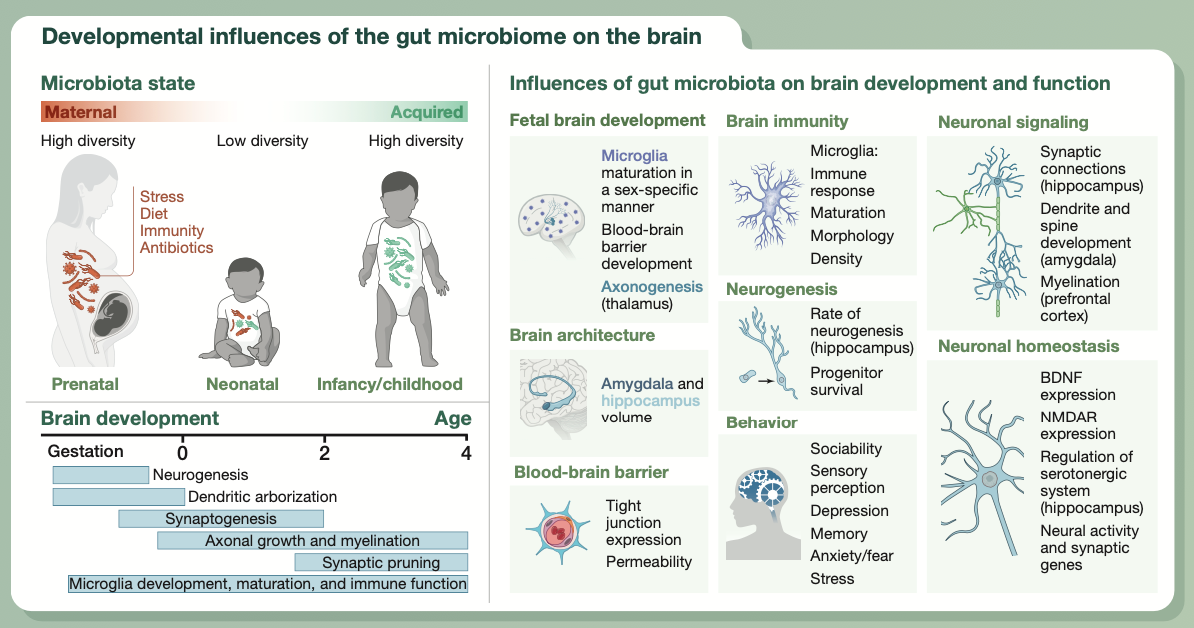
肠道菌群从生命的最初阶段就开始影响宿主的生理特性。肠道菌群的改变可能会对包括大脑在内的器官系统发育的关键过程造成损害。
动物研究表明,因无菌饲养、使用抗生素治疗或其他环境因素影响,造成母体微生物组或出生后的早期微生物组改变,可能会导致子代的大脑免疫、血脑屏障通透性、大脑结构和神经回路在调节神经元的产生、特性和成熟方面出现异常。
这些影响会持续到成年,并易导致长期的行为缺陷,这突出了在神经发育的关键窗口期,维持微生物组平衡的重要性。虽然微生物组对胎儿稳态的影响的证据正在喷涌而出,但还需要进一步的研究,来揭示肠道微生物调节早期大脑发育和成熟的确切机制。
肠道菌群和中枢神经系统(CNS)之间的交流至少可以通过三条平行且相互联系的途径实现。
途径1:免疫
肠道菌群与肠道免疫系统之间存在密切的互作。包括代谢产物(例如短链脂肪酸 SCFAs)和膜成分(例如多糖 A)在内的微生物组成分均可影响免疫稳态,形成促炎或抗炎的局部免疫反应。
微生物与局部免疫细胞的相互作用,可导致超越胃肠道功能的变化,例如,改变进入体循环的细胞因子的释放,或调节位于其他身体部位(如大脑)的免疫细胞。
除了对周围免疫细胞的作用外,据报道,肠道菌群还可以调节位于大脑的免疫细胞——小胶质细胞的发育、成熟和功能。
在神经炎症的背景下,血脑屏障通透性的改变,可促进微生物组分通过这一屏障,以及外周免疫细胞对脑实质的侵袭。中风等疾病引起的大脑炎症会改变肠道菌群的组成,从而导致恶性循环——肠道菌群失调进一步加剧神经免疫反应,从而加重了大脑病理的严重程度。
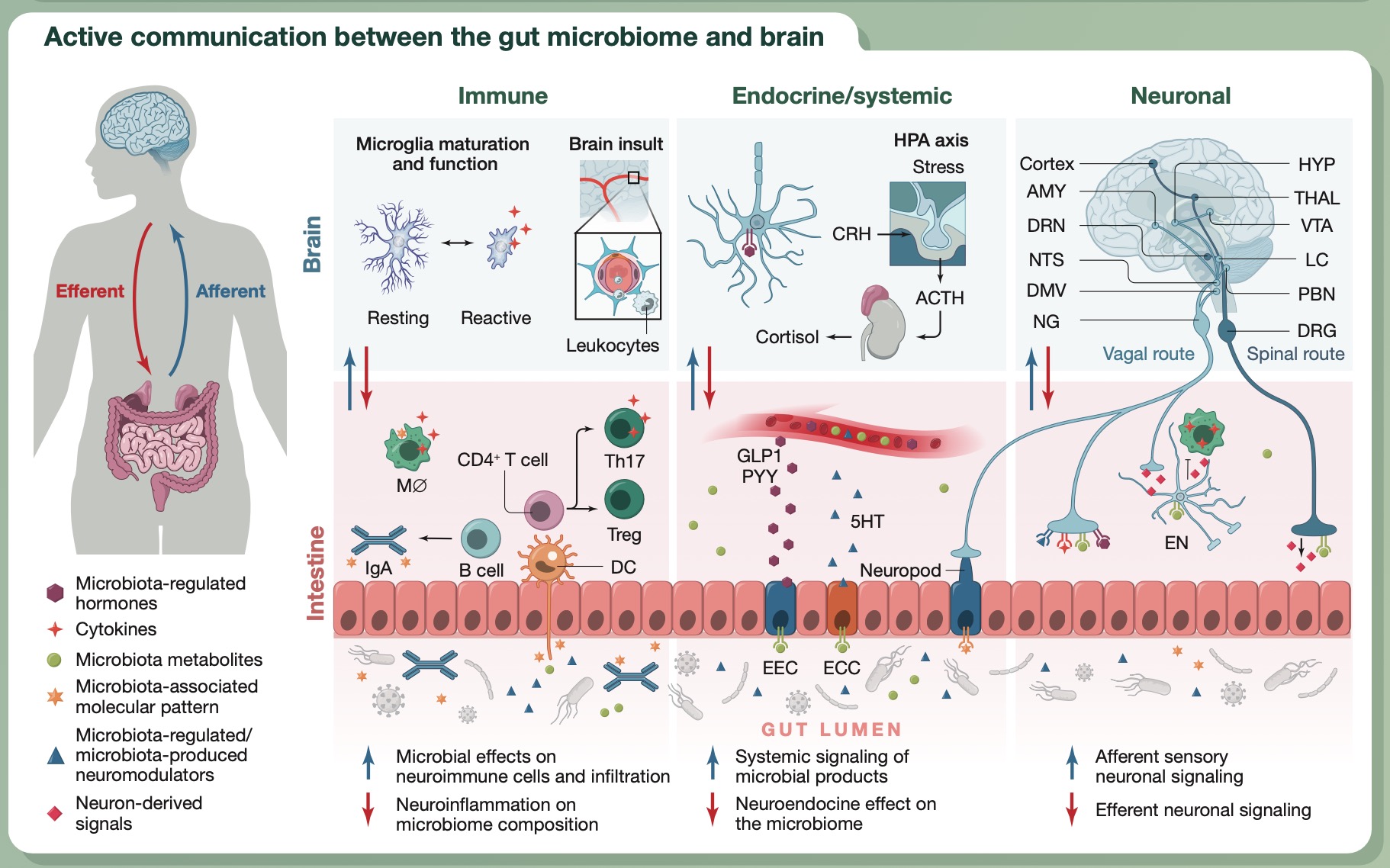
图. 肠道菌群与大脑间的交流:ACTH,促肾上腺皮质激素;AMY,杏仁核;ASD,自闭症谱系障碍;CRH,促肾上腺皮质激素释放激素;DMV,迷走神经背核;DRN,中缝背核;DRG,背根神经节;EN,肠神经元;HYP,下丘脑;GLP1,胰高血糖素样肽-1;LC,蓝斑核;MØ,巨噬细胞;NG,结状神经节。NTS,孤束核;PBN,臂旁旁核;PYY,肽YY;THAL,丘脑;VTA,中脑腹侧被盖区; 5HT,5-羟色胺(即血清素)。
途径2:内分泌/系统性
微生物组分和代谢物,如次级胆汁酸、吲哚衍生物和 SCFAs,可以通过肠道内分泌细胞(EECs)和肠嗜铬细胞(ECCs)发出信号,从而调节神经肽的分泌,例如可调节食欲的激素胰高血糖素样肽-1(GLP1)和神经调节剂(如激素和神经递质血清素)。
此外,某些肠道细菌可以直接合成和释放神经递质和神经调节剂(表1)。如果这些物质被吸收并释放到门静脉循环中,那么,它们对中枢神经元活动的影响程度将取决于它们穿越血脑屏障的能力。
据报道,肠道微生物群还与下丘脑-垂体-肾上腺(HPA)轴介导的神经内分泌信号通路有双向互作。压力诱导的 HPA 轴激活会影响肠胃功能,进而改变肠道菌群的组成。相反,肠道菌群的变化会改变 HPA 轴的功能,这一点可以从菌群缺陷小鼠在平衡期和压力反应中的糖皮质激素水平变化得知。

表1. 肠道细菌产生的神经调节剂
途径3:神经
某些微生物组分、微生物调节激素和微生物依赖性免疫介质,可直接与肠神经系统及其支配的迷走神经和脊髓传入神经相互作用。产生的局部信号可通过感觉神经回路传递到参与认知、情绪、恐惧/焦虑、躯体感觉和/或进食行为的大脑区域。
反过来,迷走神经和脊髓传出神经会传递信号至肠粘膜,并直接(如通过脊神经衍生信号调节寄生虫入侵)或间接(通过与肠神经系统的相互作用)影响胃肠稳态。
通过这种自上而下的信号或微生物相关分子调节肠道内神经元的活动,最终可影响胃肠道生理、局部免疫功能和肠道菌群的组成。
构成菌群-肠-脑轴的免疫、内分泌、系统和神经通路是高度复杂和相互关联的。
例如,刺激肠道免疫细胞可导致局部和全身释放炎症细胞因子,影响肠道和大脑的通透性,促进微生物副产物进入门静脉循环和肠壁,调节局部神经末梢的兴奋性,并最终改变大脑的平衡。
此外,被确定为关键神经调节剂的某些肠道微生物可以通过以上三种途径影响中枢神经系统在生理和/或病理情况下的功能,这进一步突出了这些生物途径之间的复杂关系(表2)。
肠道内分泌和神经系统之间的直接互动也已被揭示。EECs 的一个亚群具有一种细胞质突起,即“神经节”,它与迷走传入神经接触,起兴奋性突触的作用。这种超微结构有可能可直接、快速地将与微生物有关的信号传递给大脑,并向大脑报告胃肠道的健康情况。

表2. 肠道微生物对宿主神经功能的调节
菌群-肠-脑轴涉及跨器官系统的复杂相互作用,这些相互作用涉及多种途径,并发生在不同的时间尺度。
新的分子和细胞介质不断涌现,有可能会进一步揭示出行为背后的综合系统相互作用的基本见解,并可能进一步确定治疗大脑和行为障碍的新靶点。
不过,这都需要更多的研究来揭示健康和疾病状态下菌群-肠-脑轴信号传递的基本原理和精确机制。
参考文献:
(滑动下方文字查看)
Benakis, C., Martin-Gallausiaux, C., Trezzi, J.P., Melton, P., Liesz, A., and Wilmes, P. (2020). The microbiome-gut-brain axis in acute and chronic brain diseases. Curr. Opin. Neurobiol. 61, 1–9.
Cryan, J.F., O’Riordan, K.J., Cowan, C.S.M., Sandhu, K.V., Bastiaanssen, T.F.S., Boehme, M., Codagnone, M.G., Cussotto, S., Fulling, C., Golubeva, A.V., et al. (2019). The Microbiota-Gut-Brain Axis. Physiol. Rev. 99, 1877–2013.
Erny, D., Hrabe de Angelis, A.L., and Prinz, M. (2017). Communicating systems in the body: how microbiota and microglia cooperate. Immunology 150, 7–15.
Foster, J.A., Rinaman, L., and Cryan, J.F. (2017). Stress & the gut-brain axis: Regulation by the microbiome. Neurobiol. Stress 7, 124–136.
Jameson, K.G., Olson, C.A., Kazmi, S.A., and Hsiao, E.Y. (2020). Toward Understanding Microbiome-Neuronal Signaling. Mol. Cell 78, 577–583.
Joly, A., Leulier, F., and De Vadder, F. (2020). Microbial Modulation of the Development and Physiology of the Enteric Nervous System. Trends Microbiol. 10.1016/j.tim.2020.11.007.
Morais, L.H., Schreiber, H.L., 4th, and Mazmanian, S.K. (2020). The gut microbiota-brain axis in behaviour and brain disorders. Nat. Rev. Microbiol. 10.1038/s41579-020-00460-0.
Pronovost, G.N., and Hsiao, E.Y. (2019). Perinatal Interactions between the Microbiome, Immunity, and Neurodevelopment. Immunity 50, 18–36.
Strandwitz, P. (2018). Neurotransmitter modulation by the gut microbiota. Brain Res. 1693 (Pt B), 128–133.
Vuong, H.E., Yano, J.M., Fung, T.C., and Hsiao, E.Y. (2017). The Microbiome and Host Behavior. Annu. Rev. Neurosci. 40, 21–49.
原文链接:
https://linkinghub.elsevier.com/retrieve/pii/S0092867421003500
作者|Gulistan Agirman 和 Elaine Y. Hsiao
编译|Johnson
审校|617
编辑 | 晴晴大人


