
编者按:
随着生活和工作压力的不断增加,抑郁和焦虑已经成为当代人的常见心理疾病。而近年来的研究表明,心理健康可能与饮食存在着潜在的联系:健康的饮食模式往往与更良好的心理健康有关。而导致这一关联的可能机制之一是脑-肠轴。
那么,是否有可能通过饮食干预介导脑-肠轴,从而改善心理健康呢?
今天我们特别编译了 BMJ 杂志上关于营养与情绪的文章。希望该文能够为相关的产业人士和诸位读者带来一些启发和帮助。
关键信息:
● 相对于 “不健康”的饮食模式(如“西方饮食”),健康的饮食模式(如地中海饮食),常常伴随着更好的心理健康。
● 某些食物或饮食模式会影响血糖、免疫激活和肠道微生物组,进而可能影响情绪。
● 我们需要更多地研究食物与心理健康之间的互作机制,并确定如何以及何时可以使用营养来改善心理健康。
营养与心理健康
抑郁和焦虑是全世界最常见的心理疾病,也是致残的主要原因1。虽然抑郁和焦虑的某些亚临床症状难以确诊,可是这些症状依然会影响大部分人身心健康2。因此,我们需要新的方法来管理临床确诊的和亚临床状态的抑郁症和焦虑症。
近年来,营养与心理健康之间的关系引起了人们极大的兴趣。实际上,流行病学研究已经观察到遵循健康饮食或地中海饮食模式(即大量食用水果、蔬菜、坚果和豆类,适量食用家禽、鸡蛋和奶制品,偶尔食用红肉)与降低抑郁风险相关3。
但是,由于饮食与心理健康之间的因果关系可能会发生逆转,因而这种相关性也变得十分复杂(图 1)。例如,我们会根据心理状态而临时改变食物的选择或偏好,像是情绪低落时的“安慰性食品”或压力引起的食欲改变,这些都是人们的普遍经历。
此外,营养与长期精神疾病之间的关系也因难以维持健康饮食而变得更加扑朔迷离。维持健康饮食的各种阻碍在不同程度上影响着精神疾病患者,其中包括财务和环境等决定因素,甚至还包括精神药物对食欲的影响4。
在承认饮食与心理健康之间存在复杂、多向性关系的同时(图 1),在本文中,我们将着重探讨某些食物和饮食习惯对心理健康造成影响的可能方式。
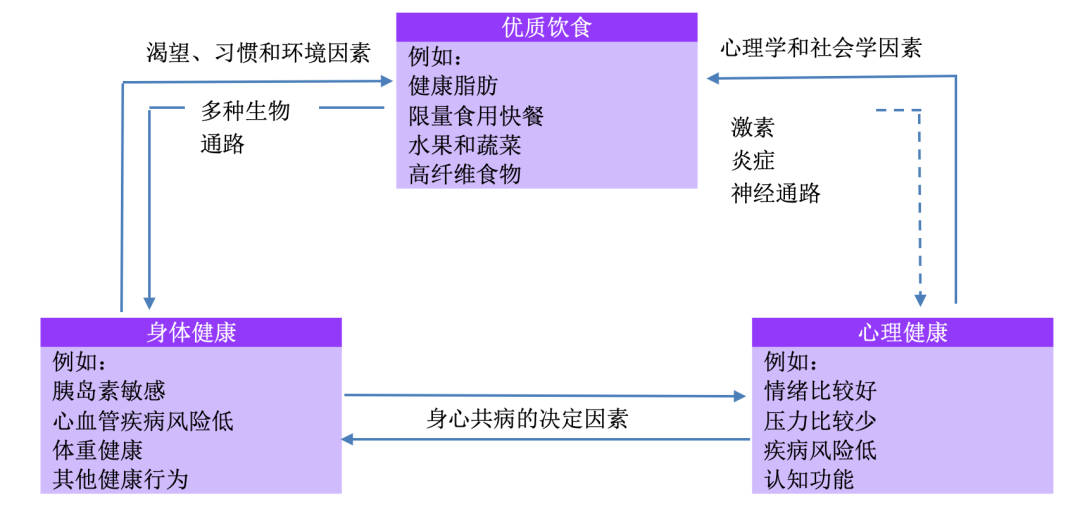
图1 .饮食、身体健康和心理健康之间的假想关系。虚线是本文的重点。
情绪与碳水化合物
食用精加工的碳水化合物会增加肥胖和糖尿病的风险5。
升糖指数按照食物中碳水化合物被消化、吸收、代谢的速度,以及最终对血糖和胰岛素水平的影响来评定食物。
高血糖指数和高血糖负荷饮食(例如,含有大量精制碳水化合物和糖的饮食)不仅对身体健康造成影响,同时也可能对心理健康产生不利影响。来自纵向研究的数据表明,逐步升高饮食的血糖指数与显现抑郁症状之间存在关联6。
临床研究还显示,精制碳水化合物对情绪的影响具有潜在的因果效应:在严格控制的实验环境中,让健康的志愿者接受高血糖负荷饮食,结果增加了他们的抑郁症状,而且效果相当显著7。
尽管情绪本身会影响我们对食物的选择,但是关于大量食用精加工的碳水化合物可能会增加抑郁和焦虑的风险也存在合理的解释,例如,反复快速地升高和降低血糖会影响情绪。
对血糖指数和血糖负荷的测量可以用来估算健康个体在进食后对血糖和胰岛素需求8。基于上述检测手段,研究发现,高血糖负荷饮食和由此产生的代偿性反应可能会降低血糖浓度,进而触发反调节激素的自动分泌,例如皮质醇、肾上腺素、生长激素和胰高血糖素5,9。
这种反应对情绪的潜在影响已经在人类实验研究中(在实验室条件下通过葡萄糖灌注逐步降低血糖浓度)得到了检验。这项研究表明,这些反调节激素可能引起焦虑、烦躁和饥饿等变化10。此外,观察性研究还发现反复发作的低血糖症与情绪失调有关9。
由于在人体研究中已经观测到高血糖指数或高血糖负荷饮食对抑郁症状具有相对快速的影响,因此,以血糖反复且快速地升高和降低来解释精制碳水化合物对心理状态的影响,似乎很恰当7。
然而,其他作用或许也能解释试验观察到的关联。例如,高血糖指数饮食是糖尿病一个危险因素5,而糖尿病又常常并发抑郁症4,11。尽管糖尿病和精神疾病的主要病理生理学模型是各自独立的,但是两种疾病都表现出共同的异常症状,即胰岛素抵抗异常、脑容量异常和神经认知能力异常,这就支持了如下假设:两种病症具有相互重叠的病理生理学12。
此外,基于人体对高血糖指数食物的炎症反应13以及心理健康与免疫活化(immune activation)之间可能存在的更广泛的联系,增加了高血糖指数饮食与抑郁症状相关的可能性。

饮食、免疫活化与抑郁
研究发现,坚持遵循地中海饮食可以减少人体中的炎症标记物(markers of inflammation)14。而富含饱和脂肪酸的高热量膳食似乎会激发免疫活化13,15。
实际上,人们已经提出高热量和富含饱和脂肪酸饮食的炎症作用正是西方饮食可能对大脑产生有害影响的原理之一,这种有害影响包括认知能力下降、海马体功能障碍和对血脑屏障的损害15。
各种精神疾病,包括情绪障碍在内,都与炎症加剧有关16,根据这种原理,不良饮食确实可能会增加罹患抑郁症的风险。
这一假设得到了观察性研究的支持,这些研究在测量抑郁症患者“饮食性炎症”时发现,他们的分值较一般人高很多3,17,其饮食特征是大量食用与炎症相关的食物(例如,反式脂肪酸和精制碳水化合物),而较少食用具有消炎特性的营养食物(例如 ω-3 脂肪酸)。然而,人们尚未确认饮食性炎症能否引起心理疾病。
尽管如此,消炎药(例如,细胞因子抑制剂和非甾体类消炎药)的随机对照试验发现,这些药物可以显著减轻抑郁症状18。
特定的营养成分(例如,多酚和多不饱和脂肪酸)和某些饮食模式(例如,地中海饮食)也可能具有消炎作用14,19,20,因此某些食品很可能能够缓解或预防与炎症恶化相关的抑郁症状21。
最近的一项研究为这种可能性提供了初步的证据20。该研究表明,引发炎症的药物通常会在服药人群中诱发抑郁状态,而在用药之前给患者服用具有消炎作用的 ω-3 脂肪酸,似乎阻止了细胞因子诱发的抑郁症20。
然而,由于几个重要的影响因素,人们对饮食、炎症和抑郁之间关系的假设变得更加复杂。例如,最近的临床研究发现,前一天所经历的压力,或者个体的严重抑郁病史,可能会抵消健康食品对炎症和情绪的有益作用22。
此外,由于加剧的炎症反应仅在某些抑郁症患者中出现,抗炎干预措施可能仅仅有益于某些具有“炎症表型(inflammatory phenotype)”特征的人,或是并发炎症疾病的患者18。因此,我们还需要做进一步的干预研究,以确定饮食对于免疫调节的改善是否可以减轻炎症疾病患者的抑郁症状。

脑、肠道微生物组与情绪
食物怎样对我们的心理健康产生影响?最新的解释是饮食方式通过影响肠道微生物组而影响我们的心理健康。
肠道微生物组是指生活在人体肠道中的数万亿的微生物,包括细菌、病毒和古菌。肠道微生物组利用神经、炎症和激素信号通路与大脑进行双向交互作用23。
科学家们提出,当大脑与肠道微生物组之间的相互作用发生改变时,就会对心理健康产生影响,其中的依据如下:啮齿类动物的情感行为随肠道微生物组的变化而改变24,人类的重度抑郁症(major depressive disorder)与肠道微生物组的改变有关25,将抑郁症患者的肠道菌群通过粪便移植到啮齿动物中似乎可以诱导动物产生出某些与抑郁症状类似的行为。
除了遗传因素和抗生素外,饮食很可能是整个生命中影响肠道微生物组的多样性、相对丰富性(relative abundance)和功能性的决定因素。
例如,西方饮食引起的神经认知作用以及全身免疫活化(如上所述)的潜在介导作用(mediating role)可能都是由粘液层受损所致(无论上皮通透性增加或不增加)。
这种肠道屏障功能的减弱有时被称为“肠漏”,并与由低纤维、高饱和脂肪酸、精制糖和人造甜味剂的饮食所导致的“不健康”肠道微生物组有关15,23,27。
相反,食用高纤维、多酚和不饱和脂肪酸的饮食(如地中海饮食中的食物)可以促进肠道微生物分类群的发展,从而可将这些食物代谢成为抗炎性代谢产物15,28,例如短链脂肪酸,并降低仲胆汁酸(secondary bile acids)和对甲酚(p-cresol)的产量。
此外,最近的一项研究发现,健康个体摄入益生菌(理论上是针对肠道微生物组的益生菌),可以改变大脑对需要情感关注的任务的反应29,甚至可以减轻抑郁的症状30。
综合来看,这些研究提供了极具希望的证据,证明肠道微生物组在调节人脑情绪的过程中发挥了作用。但是,到目前为止,尚未建立特定微生物或其代谢产物与复杂人类情感之间的因果关系。
此外,由饮食引起的肠道微生物组的变化是否会影响抑郁症状或抑郁症,以及这种影响可能发生的时间段还有待研究。

优先事项和下一步
在这个活跃的研究领域中探索时,最重要的是不要一叶障目,不见森林——也就是说,过于关注细节而忽略了更宏观的问题。
发现单一营养素的抗炎特性或许揭示了肠道与大脑之间的相互作用的微妙之处,并且可能为食物如何影响情绪提供了新的认识,但重要的是不要忽略我们已经知晓的饮食影响心理健康的其它途径。
例如,不良饮食的后果包括肥胖和糖尿病,人们已经证实两者与较差的心理健康相关11,31~33。关于这些合并症影响的完整讨论不在本文讨论范围之内(见图 1),但必须承认,制定公共卫生提案来有效解决身心合并症的已知危险因素是改善人口健康的第一要务。
我们需要进一步的研究来加深理解饮食和营养可能影响大脑的各种复杂途径。这些知识可能引发人们去研究更有针对性的甚至是个性化的干预方法,从而通过营养学方法改善情绪、减轻焦虑或其它症状。
但就目前来说,这些可能性尚属推测,我们需要进行更多的干预研究来确定饮食干预措施是否能够、如何以及何时能够用于预防精神疾病或减轻终身患者的症状。
值得一提的是,最近的一项大型临床试验发现,对具有亚临床抑郁症状的成年人进行地中海饮食干预并没有获得显著成效34。
另一方面,近期对抑郁症患者进行的几项较小的试验发现,基于地中海饮食的干预措施产生了相当大的改善35,37。
但是,这些试验结果必须考虑到人们的期望值所产生的影响,尤其是考虑到个体对食物或饮食品质的信心也可能显著地影响到他们对整体健康与幸福的感觉38。不管怎样,即使抛开心理影响,鉴于心理疾病患者的心脏代谢疾病(cardio-metabolic diseases)的发病率较高,在精神保健护理中考虑到饮食因素也可能有助于改善身体健康33。
与此同时,必须要牢记,精神疾病的成因多种多样,并且它们通常会独立于营养和饮食单独呈现且持续存在。因此,对食物与心理健康之间潜在联系的深入了解不应用来支持对个人饮食选择及其心理健康的臆断或歧视。实际上,这种歧视本身可能成为增加精神健康风险的偶然因素。
不管怎样,正在进行的研究已经逐步给出让公共卫生和临床机构充满希望的信息,支持他们创造条件和制定措施来促进健康而营养的饮食,同时减少食用高度加工和精制的“垃圾”食品,人们由此所收益的将不仅仅是众所周知的身体健康,还包括心理健康的改善。
参考文献:
(滑动下方文字查看)
1.Friedrich MJ. Depression is the leading cause of disability around the world. JAMA2017;317:1517. doi:10.1001/jama.2017.3826 pmid:28418490
2.Johnson J, Weissman MM, Klerman GL. Service utilization and social morbidity associated with depressive symptoms in the community. JAMA1992;267:1478-83. doi:10.1001/jama.1992.03480110054033 pmid:1538538Web of Science
3.Lassale C, Batty GD, Baghdadli A, et al. Healthy dietary indices and risk of depressive outcomes: a systematic review and meta-analysis of observational studies. Mol Psychiatry2019;24:965-86. doi:10.1038/s41380-018-0237-8 pmid:30254236
4.Firth J, Siddiqi N, Koyanagi A, et al. The Lancet Psychiatry Commission: a blueprint for protecting physical health in people with mental illness. Lancet Psychiatry2019;6:675-712. doi:10.1016/S2215-0366(19)30132-4 pmid:31324560
5.Ludwig DS. The glycemic index: physiological mechanisms relating to obesity, diabetes, and cardiovascular disease. JAMA2002;287:2414-23. doi:10.1001/jama.287.18.2414 pmid:11988062Web of Science
6.Gangwisch JE, Hale L, Garcia L, et al. High glycemic index diet as a risk factor for depression: analyses from the Women’s Health Initiative. Am J Clin Nutr2015;102:454-63. doi:10.3945/ajcn.114.103846 pmid:26109579Abstract/FREE Full Text
7.Salari-Moghaddam A, Saneei P, Larijani B, Esmaillzadeh A. Glycemic index, glycemic load, and depression: a systematic review and meta-analysis. Eur J Clin Nutr2019;73:356-65. doi:10.1038/s41430-018-0258-z pmid:30054563
8.Bao J, de Jong V, Atkinson F, Petocz P, Brand-Miller JC. Food insulin index: physiologic basis for predicting insulin demand evoked by composite meals. Am J Clin Nutr2009;90:986-92. doi:10.3945/ajcn.2009.27720 pmid:19710196Abstract/FREE Full Text
9.Seaquist ER, Anderson J, Childs B, et al., American Diabetes Association, Endocrine Society. Hypoglycemia and diabetes: a report of a workgroup of the American Diabetes Association and the Endocrine Society. J Clin Endocrinol Metab2013;98:1845-59. doi:10.1210/jc.2012-4127 pmid:23589524Web of Science
10.Towler DA, Havlin CE, Craft S, Cryer P. Mechanism of awareness of hypoglycemia. Perception of neurogenic (predominantly cholinergic) rather than neuroglycopenic symptoms. Diabetes1993;42:1791-8. doi:10.2337/diab.42.12.1791 pmid:8243825Abstract/FREE Full Text
11.Salvi V, Hajek T. Brain-metabolic crossroads in severe mental disorders. Front Psychiatry2019;10:492. doi:10.3389/fpsyt.2019.00492 pmid:31354549
12.McIntyre RS, Kenna HA, Nguyen HT, et al. Brain volume abnormalities and neurocognitive deficits in diabetes mellitus: points of pathophysiological commonality with mood disorders?Adv Ther2010;27:63-80. doi:10.1007/s12325-010-0011-z pmid:20390390
13.O’Keefe JH, Gheewala NM, O’Keefe JO. Dietary strategies for improving post-prandial glucose, lipids, inflammation, and cardiovascular health. J Am Coll Cardiol2008;51:249-55. doi:10.1016/j.jacc.2007.10.016 pmid:18206731FREE Full Text
14.Kastorini C-M, Milionis HJ, Esposito K, Giugliano D, Goudevenos JA, Panagiotakos DB. The effect of Mediterranean diet on metabolic syndrome and its components: a meta-analysis of 50 studies and 534 906 individuals. J Am Coll Cardiol2011;57:1299-313. doi:10.1016/j.jacc.2010.09.073 pmid:21392646FREE Full Text
15.Noble EE, Hsu TM, Kanoski SE. Gut to brain dysbiosis: mechanisms linking western diet consumption, the microbiome, and cognitive impairment. Front Behav Neurosci2017;11:9. doi:10.3389/fnbeh.2017.00009 pmid:28194099
16.Yuan N, Chen Y, Xia Y, Dai J, Liu C. Inflammation-related biomarkers in major psychiatric disorders: a cross-disorder assessment of reproducibility and specificity in 43 meta-analyses. Transl Psychiatry2019;9:233. doi:10.1038/s41398-019-0570-y pmid:31534116
17.Firth J, Stubbs B, Teasdale SB, et al. Diet as a hot topic in psychiatry: a population-scale study of nutritional intake and inflammatory potential in severe mental illness. World Psychiatry2018;17:365-7. doi:10.1002/wps.20571 pmid:30192082
18.Köhler-Forsberg O, N Lydholm C, Hjorthøj C, Nordentoft M, Mors O, Benros ME. Efficacy of anti-inflammatory treatment on major depressive disorder or depressive symptoms: meta-analysis of clinical trials. Acta Psychiatr Scand2019;139:404-19. doi:10.1111/acps.13016 pmid:30834514
19.Yahfoufi N, Alsadi N, Jambi M, Matar C. The immunomodulatory and anti-inflammatory role of polyphenols. Nutrients2018;10:E1618. doi:10.3390/nu10111618 pmid:30400131
20.Su K-P, Lai H-C, Yang H-T, et al. Omega-3 fatty acids in the prevention of interferon-alpha-induced depression: results from a randomized, controlled trial. Biol Psychiatry2014;76:559-66. doi:10.1016/j.biopsych.2014.01.008 pmid:24602409Web of Science
21.Borsini A, Alboni S, Horowitz MA, et al. Rescue of IL-1β-induced reduction of human neurogenesis by omega-3 fatty acids and antidepressants. Brain Behav Immun2017;65:230-8. doi:10.1016/j.bbi.2017.05.006 pmid:28529072
22.Kiecolt-Glaser JK, Fagundes CP, Andridge R, et al. Depression, daily stressors and inflammatory responses to high-fat meals: when stress overrides healthier food choices. Mol Psychiatry2017;22:476-82. doi:10.1038/mp.2016.149 pmid:27646264
23.Osadchiy V, Martin CR, Mayer EA. Gut microbiome and modulation of CNS function. Compr Physiol2019;10:57-72. doi:10.1002/cphy.c180031 pmid:31853944
24.Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci2012;13:701-12. doi:10.1038/nrn3346 pmid:22968153
25.Kelly JR, Borre Y, O’Brien C, et al. Transferring the blues: depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res2016;82:109-18. doi:10.1016/j.jpsychires.2016.07.019 pmid:27491067
26.Kelly JR, Keane VO, Cryan JF, Clarke G, Dinan TG. Mood and microbes: gut to brain communication in depression. Gastroenterol Clin North Am2019;48:389-405. doi:10.1016/j.gtc.2019.04.006 pmid:31383278
27.Sonnenburg ED, Sonnenburg JL. The ancestral and industrialized gut microbiota and implications for human health. Nat Rev Microbiol2019;17:383-90. doi:10.1038/s41579-019-0191-8 pmid:31089293
28.Ghosh TS, Rampelli S, Jeffery IB, et al. Mediterranean diet intervention alters the gut microbiome in older people reducing frailty and improving health status: the NU-AGE 1-year dietary intervention across five European countries. Gut2020;69:1218-28. doi:10.1136/gutjnl-2019-319654 pmid:32066625Abstract/FREE Full Text
29.Tillisch K, Labus J, Kilpatrick L, et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology2013;144:1394-401, 1401.e1-4. doi:10.1053/j.gastro.2013.02.043. pmid:23474283
30.Liu RT, Walsh RFL, Sheehan AE. Prebiotics and probiotics for depression and anxiety: a systematic review and meta-analysis of controlled clinical trials. Neurosci Biobehav Rev2019;102:13-23. doi:10.1016/j.neubiorev.2019.03.023 pmid:31004628
31.Wootton RE, Lawn RB, Millard LAC, et al. Evaluation of the causal effects between subjective wellbeing and cardiometabolic health: Mendelian randomisation study. BMJ2018;362:k3788. doi:10.1136/bmj.k3788 pmid:30254091Abstract/FREE Full Text
32.Jebeile H, Gow ML, Baur LA, Garnett SP, Paxton SJ, Lister NB. Association of pediatric obesity treatment, including a dietary component, with change in depression and anxiety: a systematic review and meta-analysis. JAMA Pediatr2019;173:e192841. doi:10.1001/jamapediatrics.2019.2841 pmid:31524933
33.Ma J, Rosas LG, Lv N, et al. Effect of integrated behavioral weight loss treatment and problem-solving therapy on body mass index and depressive symptoms among patients with obesity and depression: the RAINBOW randomized clinical trial. JAMA2019;321:869-79. doi:10.1001/jama.2019.0557 pmid:30835308
34.Bot M, Brouwer IA, Roca M, et al., MooDFOOD Prevention Trial Investigators. Effect of multinutrient supplementation and food-related behavioral activation therapy on prevention of major depressive disorder among overweight or obese adults with subsyndromal depressive symptoms: the MooDFOOD randomized clinical trial. JAMA2019;321:858-68. doi:10.1001/jama.2019.0556 pmid:30835307
35.Francis HM, Stevenson RJ, Chambers JR, Gupta D, Newey B, Lim CK. A brief diet intervention can reduce symptoms of depression in young adults – a randomised controlled trial. PLoS One2019;14:e0222768. doi:10.1371/journal.pone.0222768 pmid:31596866
36.Jacka FN, O’Neil A, Opie R, et al. A randomised controlled trial of dietary improvement for adults with major depression (the ‘SMILES’ trial). BMC Med2017;15:23. doi:10.1186/s12916-017-0791-y. pmid:28137247
37.Parletta N, Zarnowiecki D, Cho J, et al. A Mediterranean-style dietary intervention supplemented with fish oil improves diet quality and mental health in people with depression: A randomized controlled trial (HELFIMED). Nutr Neurosci2019;22:474-87. doi:10.1080/1028415X.2017.1411320. pmid:29215971
38.Rozin P, Fischler C, Imada S, Sarubin A, Wrzesniewski A. Attitudes to food and the role of food in life in the USA, Japan, Flemish Belgium and France: possible implications for the diet-health debate. Appetite1999;33:163-80. doi:10.1006/appe.1999.0244 pmid:10502362Web of Science
39.Hunt A, Harrington D, Robinson S. Vitamin B12 deficiency. BMJ2014;349:g5226. doi:10.1136/bmj.g5226 pmid:25189324
原文链接:https://www.bmj.com/content/369/bmj.m2382
作者|Joseph Firth、James E Gangwisch、Alessandra Borisini、Robyn E Wootton 和 Emeran A Mayer
编译|猫
审校|617


