
编者按:
《2019 年全球卫生估计报告》显示,在过去 20 年,阿尔茨海默病(AD)和其他形式的痴呆症已经成为全球十大死因之一。截至 2019 年,我国有超过 1 千万名 AD 患者,是全球 AD 患者数量最多的国家,占世界 AD 患者总人口的 1/4,而且这个数字还在随人口老龄化不断攀升。
近年来,一些临床和实验证据都提示肠道菌群在神经退行性疾病的发生及发展中扮演着重要角色,粪菌移植(FMT)有望成为预防或治疗 AD 的良方。
今天,我们共同关注 FMT 在神经系统疾病,尤其在是 AD 症中的应用进展,希望为相关的产业人士和读者带来一些启发和帮助。
肠道菌群在调节肠-脑轴方面起着关键作用,这是一个双向通信网络,涉及到中枢神经系统、自主神经系统(交感神经和副交感神经分支)、肠道神经系统和下丘脑-垂体-肾上腺轴1。
最近的研究表明,人类肠道菌群具有许多有益功能,例如帮助免疫系统发育、抵抗病原体、合成维生素、产生短链脂肪酸(SCFA)等代谢物、代谢药物、产生营养以及维持肠黏膜屏障的结构完整性2。
在人体中已经发现菌群的失调和改变会诱发炎症性肠病、2 型糖尿病、代谢综合征、肥胖、结直肠癌、阿尔茨海默病(AD)和许多其它疾病3。
AD 是一种灾难性的神经系统疾病,截至 2020 年,它影响了 580 万 65 岁及以上的美国人。预计到 2060 年,这一数字将增加到 1400 万。随着 AD 患病率的增加,全球痴呆症的总成本预计将在 2030 年增加到 2.0 万亿美元4。2017 年,AD 是第 6 大最常见死因,在美国造成 121,404 人死亡,在美国老年人(65 岁以上)中更是排名第 5 位的最常见死因5。
AD 造成的巨大经济负担及其日益流行,促使研究人员寻找预防或改善疾病的治疗方法。目前有各种肠道菌群调节干预措施,例如调整饮食、益生元、益生菌、合生制剂或粪菌移植(FMT)。
FMT 是指将肠道菌群从供体移植到受体,以修复受体的肠道菌群的方法,它已被证明可成功治疗复发性艰难梭菌感染6。在这篇综述中,我们总结了 FMT 的流程及其在治疗各种神经系统疾病,特别是 AD 中的应用。
在西方国家,超过 4000 万老年人患有 AD,占所有痴呆病例的 65%以上。全球人口预期寿命的增加也导致了包括 AD 在内的与年龄相关的疾病患病率增加7。当前,错误折叠的淀粉样蛋白 β(Aβ)斑块和高磷酸化 tau 蛋白沉积形成的神经原纤维缠结(NFT),仍然是 AD 诊断的主要神经病理学标准8。
尽管已知 AD 最大的风险因素是年龄,但遗传、家族史、生活方式和环境等多种因素都可能会影响 AD 的发病。越来越多的证据表明,自然存在于体内的微生物与 AD 的许多标志性特征(包括 Aβ 斑块和 NFT)的发展之间存在联系9。
研究表明,肠道菌群在一些大脑进程中起着至关重要的作用,如髓鞘形成、小胶质细胞激活和神经发生,这与行为、情绪和认知调节密切相关10。除了衰老、不健康饮食、压力或肥胖之外,能影响肠道菌群组成的其它因素也与 AD 相关11。
例如受损的肠道菌群会改变上皮结肠细胞中紧密连接蛋白(即 zonulin 和 occludin)的表达。由于紧密连接能力的改变,肠道通透性增加。受损的肠道微生物组成还会增加脂多糖、淀粉样蛋白和三甲胺 N-氧化物,同时减少有益代谢物,如 SCFA 和氢的产生11。
Toll 样受体(TLR)2 和 TLR 4 暴露于肠道致病菌后被激活。这导致核因子 kappaB(NFkB)激活和促炎细胞因子白细胞介素 12(IL-12)的分泌。当 IL-12 增加时,T-helper(Th)1/Th2 免疫反应得到改善,并伴随着肿瘤坏死因子(TNF)、干扰素-γ(IFN-γ)和 IL-6(白细胞介素 6)12水平的升高。结果,水平升高的促炎细胞因子通过渗漏血脑屏障(BBB)进入了中枢神经系统(由于内皮紧密连接被破坏),导致血源性免疫细胞(如巨噬细胞和中性粒细胞)的易位。
此外,由于细胞因子和微生物等炎症介质或细菌产物,小胶质细胞被激活,导致细胞外基质分解,以及星形胶质细胞、周细胞和神经元细胞功能障碍13。这种级联反应是 Aβ 和 tau 积累的触发因素,会诱导神经变性和 AD 病理学进展(图1)。
在最近的研究中,Cattaneo 等人指出,认知障碍和大脑中的淀粉样蛋白沉积与促炎类群埃希氏菌属/志贺氏菌属的丰度增加和抗炎类群直肠真杆菌的减少有关14。
在健康个体中,厚壁菌门和拟杆菌门这两个门约占肠道菌群的 90%,余下的由放线菌门、变形菌门、梭杆菌门和疣微菌门组成15。Vogt 等人检查了 AD 患者的粪便样本,并将其与对照组(年龄和性别匹配的个体)进行比较。
根据这项研究,AD 的微生物组中,厚壁菌门和双歧杆菌属较少,而拟杆菌门较多。此外,他们观察到部分菌属的相对丰度与 AD 脑脊液生物标志物水平之间的相关性16。
根据 Bäuerl 等人的说法,转基因 APP/PS1(Tg)小鼠模型也成功地展示了 AD 如何改变肠道细菌谱——趋向于变形菌门和韦荣球菌科,这可能诱导疾病进展和恶化17。Cox 等人证明拟杆菌的定植会促进 Aβ 沉积,而长期热量限制可能会肠道环境改变,并抑制某些微生物的生长,而这些微生物与年龄相关的认知能力下降有关18。
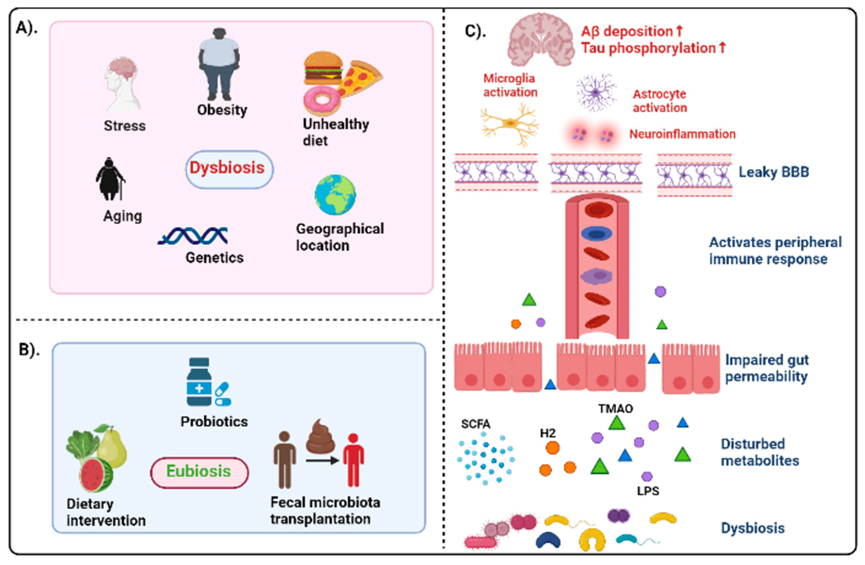 图1:(A)影响生态失调的各种因素,即肠道菌群的改变。(B)各种菌群调控技术。(C)代表生态失调和 AD 病理之间相互作用的示意图。Aβ:淀粉样蛋白-β;AD:阿尔茨海默病;BBB:血脑屏障;LPS:脂多糖;SCFA:短链脂肪酸;TMAO:三甲胺 N-氧化物。
图1:(A)影响生态失调的各种因素,即肠道菌群的改变。(B)各种菌群调控技术。(C)代表生态失调和 AD 病理之间相互作用的示意图。Aβ:淀粉样蛋白-β;AD:阿尔茨海默病;BBB:血脑屏障;LPS:脂多糖;SCFA:短链脂肪酸;TMAO:三甲胺 N-氧化物。
众所周知,菌群失调与神经退行性疾病的发展密切相关,对肠道菌群的调控也可以在对抗 AD 中发挥关键作用。由于 AD 没有明确的治疗方法,因此,当前针对 AD 的大多数疗法只是延迟认知和记忆的丧失。
最近的几项研究揭示了人体微生物组介导肠-脑轴调节多种神经化学途径的作用19。研究表明,植物性饮食,omega-3 多不饱和脂肪酸,抗氧化剂和减少膳食饱和脂肪、动物源性蛋白质和精制糖的饮食可以缓解认知能力下降,并降低 AD 早期发病的风险20。基于饮食的治疗干预包括热量限制、富含益生元的饮食、富含益生菌的饮食、补充益生菌和多酚19。
益生菌有助于促进接受者的健康,而益生元是益生菌的主要食物来源21。Bonfili 等人的一项研究使用了乳杆菌(Lactobacillus acidophilus、L. brevis、L. delbrueckii subsp. bulgaricus、L. paracasei、L. plantarum)和双歧杆菌(Bifidobacterium breve、B. longum、B. infantis)的混合物(称为 SLAB51)处理 AD 转基因模型小鼠。
四个月后,在 AD 小鼠中观察到双歧杆菌的增加和弯曲菌目的减少。在服用 SLAB51 的 AD 小鼠中,还观察到了肠道菌群的代谢物,如可改善认知功能的 SCFA 含量的改变22。
Ho 等人的一项研究报道了肠道菌群在一定程度上会通过增加特定 SCFA 的产生,来抑制 Aβ 可溶性聚集体形成,从而预防 AD23。
在一项研究中,Kobayashi 等人表明 B. breve A1 的摄入降低了海马神经元中的炎症和免疫反应基因的表达。在最近的一项研究中,Abraham 等人表明与未服用益生菌的小鼠相比,益生菌足以改善 AD 小鼠的认知能力24。
除了饮食干预和益生菌外,FMT 是调节肠道菌群的最有效的治疗选择。这种方法已显示出对各种神经系统疾病,如 AD、帕金森病(PD)和多发性硬化症(MS)的改善。
大约 1700 年前,在把人类粪便称为“黄汤”时,一位名叫葛洪的中国医学家引入了 FMT 的概念,即口服“汤”药治疗严重腹泻或胃肠炎患者25。
出生于德国的科学家 Christian Paullini 是第一个以“Heilsame Dreck-Apotheke”工作证明了人类排泄物具有治疗潜力的人26。
1958 年,Eiseman 等人在对四个案例进行研究时,首次使用了人类粪便灌肠剂治疗伪膜性结肠炎27。
随后,Borody 等人对一名难治性溃疡性结肠炎患者进行了“肠道菌群交换”,该患者在治疗后显示出完全和持久的临床恢复28。
2013 年,vanNood 等人注意到,在复发性艰难梭菌感染患者中,与单独使用抗生素相比,加入供体粪便具有更好的疗效29。
 图 2:FMT 程序和相关不良事件的示意图。CMV:巨细胞病毒;FMT:粪菌移植;IBD:炎症性肠病。
图 2:FMT 程序和相关不良事件的示意图。CMV:巨细胞病毒;FMT:粪菌移植;IBD:炎症性肠病。
FMT 的捐赠者可以从亲密伴侣、家庭成员或无关的志愿者中选择(图2)30。通常认为具有以下情况的供体不适合招募:三个月内服用过抗生素;正在服用免疫抑制剂或化疗药物;最近感染艾滋病毒或乙型或丙型肝炎;肥胖,患有炎症性肠病(IBD)或肠易激综合征;有潜在感染、胃肠道恶性肿瘤、息肉病、高危性行为和使用非法药物;近期有被监禁史或曾到过流行性腹泻地区31,32。
对于具有可接受医疗史的潜在捐赠者,需要通过血液和粪便检查来筛查其是否患有传染病33。如今,由于冠状病毒病大流行,有人建议通过鼻咽聚合酶链反应和直肠拭子 RNA 检测,来确认供体是否有 SARS-CoV-2 的感染34。
潜在捐赠者可以在筛查后的一个月内提供新鲜粪便。收集后的粪便密封于干净的不透明塑料袋中,然后将其放入更大的储存袋中。尽管用于FMT的理想粪便重量尚未标准化,但建议每次治疗使用约 50 至 60 克的粪便。
粪便可以在 4°C 下储存长达 8 小时,因为在 4°C 或室温下储存 8 小时后,细菌存活率会下降。通过手动搅拌或使用搅拌器将粪便溶解在大约 150mL 的生理盐水中35。然后将混合物通过无菌纱布垫或钢过滤器过滤以去除大颗粒物质36。此后,将悬浮液吸入 60mL 导管尖端注射器中。
此外,最终的粪便材料应明确标记并储存在 -80°C。在输注当天,应在 37°C 的温水浴中解冻,并在解冻后 4 小时内进行灌注32(图 2)。
FMT 可以在结肠镜检查时直接施用于结肠(84-93%的有效率)37,较少情况通过软性乙状结肠镜检查或灌肠38。对于有肠梗阻、严重结肠炎或结肠镜检查禁忌症的患者,可以通过鼻肠管、食管胃十二指肠镜检查或胶囊摄入来实施 FMT(图 2)38。
胶囊递送是 FMT 的最新施用方式,这似乎有利于那些反对通过胃肠道通路,或与结肠镜检查的机构地理位置相距较远的人39。
在 FMT 之前,患者必须做好充分准备工作,以确保体内无残留粪便35。如果粪便溶液是通过结肠镜检查给药的,接受者通常会进行肠道准备,以清除预先存在的细菌。当使用鼻胃管输送粪便样本时,可以提前给质子泵抑制剂,以增加移植细菌的存活率(图2)40。
总的来说,FMT 是一种安全有效的治疗方法,副作用有限。最近的许多大型研究证实,最有可能发生的轻微不良事件主要为腹泻、便秘、腹部不适、腹胀和瞬态低烧等,但会在数天至数周内消退。此外,还有一些罕见的严重副作用,如高烧,IBD 病情恶化,感染、败血症,肠道病原体传播,穿孔,出血,巨细胞病毒再激活及肺炎41,这些与内窥镜检查和镇静有关(图 2)。
在一些病例报告中,FMT 与某些疾病(如类风湿性关节炎、特发性血小板减少性紫癜和周围神经病变)之间可能存在某种联系42。操作者应在手术前告知接受者 FMT 潜在的不良反应。

通过 FMT 恢复肠道菌群组成和调节菌群失调可能是治疗各种神经系统疾病的有效方法,但当前的证据依然有限。
在 Zhan 等人进行的一项实验中,小鼠首先接受连续 14 天的广谱抗生素治疗。随后,作者将来自衰老加速小鼠易感型 8(SAMP8)或抗衰加速小鼠 1(SAMR1)小鼠的粪菌移植到伪无菌(pseudo-germ-free)小鼠中,结果他们观察到,接受了来自 SAMR1 小鼠的伪无菌小鼠的空间学习和记忆能力得到改善43,而接受 SAMP8 小鼠粪菌移植的则没有。
Yu 等人分别使用了有和无认知功能恶化的糖尿病小鼠,并将无认知功能障碍小鼠的粪菌移植到伪无菌小鼠的肠道中。他们注意到宿主 Morris 水迷宫性能指数的显着改善,该影响与宿主肠道微生物的 β 多样性及相对丰度变化有关44。
此外,Dodiya 等人证明将粪便菌群从没有使用过抗生素的 AD 雄性小鼠移植到抗生素处理过的 AD 雄性小鼠(年龄和性别相匹配)中后,后者重构了肠道细菌,并部分修复了 Aβ 病理学和小胶质细胞形态。
他们在抗生素治疗过雄性小鼠中,观察到抗炎细胞因子(例如 IL-10)的表达相对较高,而促炎细胞因子(包括 IL-1B、IL-2、IL-3、IL-17A、LIX(CXC5)、RANTES(CCL5),以及 CD30 和 CD40 的表达较低45。
Fuji 等人通过将来自健康人和 AD 患者的粪便样本移植到无菌小鼠身上,构建了人源化小鼠模型。他们注意到从 AD 患者移植的肠道菌群显著地影响了小鼠行为。此外,他们还注意到移植了 AD 患者菌群的小鼠粪便中与神经系统相关的代谢物,包括 γ-氨基丁酸、牛磺酸和缬氨酸的表达量较低46。
最近,Sun 等人使用 APPswe/PS1dE9 转基因(Tg)小鼠模型表明,FMT 可以减少 Aβ 的脑沉积,并降低 tau 蛋白的磷酸化、Aβ40 和 Aβ42 的水平。此外,在 Tg 小鼠中也观察到认知功能的改善和突触可塑性的增加,进一步证明了 FMT 是 AD 的潜在治疗策略47。
Hazan 在 2020 年报告了一名 82 岁的 AD 患者病例,他从他 85 岁的妻子那里接受了一次 FMT,结果,他的艰难梭菌感染症状在随后的两个月内消退了。此外,经过两个月的 FMT,患者的简易精神状态检查(MMSE)评分从 20(轻度认知障碍)增加到 26(认知功能正常),四个月后得到进一步改善(MMSE 评分为 29)48。
Holsinger 等人将野生型供体的粪菌移植给了 5XFAD 小鼠。7 天后,5XFAD 小鼠的空间和识别记忆得到改善,淀粉样蛋白病理减少,展示了 FMT 治疗 AD 的功效49。

PD(帕金森症)是一种进行性神经系统疾病,主要影响大脑特定区域(称为黑质)中产生多巴胺的神经元。PD 患者可能会出现静止性震颤、运动迟缓、肢体僵硬、步态和平衡问题。
Sun 等人使用 PD 小鼠模型证明肠道菌群失调参与 PD 发病机制。来自健康小鼠的 FMT 可改善 PD 小鼠运动功能,增加其纹状体神经递质,并减少其神经炎症50。
Zhou 等人的另一项研究注意到接受了来自正常小鼠粪菌的 PD 小鼠的多巴胺水平增加51。
MS(多发性硬化)是一种中枢神经系统脱髓鞘疾病,当免疫系统攻击神经的保护层,就会破坏大脑和身体之间的交流。有研究表明,继发性进展性 MS 并伴随复发性艰难梭菌感染患者在仅接受 FMT 治疗后,不仅解决了复发性艰难梭菌感染,还在长达 10 年的时间内有效阻止了 MS 的发展52。
Li 等人使用实验性自身免疫性脑脊髓炎(一种 MS 小鼠模型)进行了一项研究。他们观察到 FMT 可以纠正失衡的肠道菌群,并保护 BBB、髓鞘和轴突,还可以减少小胶质细胞和星形胶质细胞的活化,从而表明 FMT 或可作为 MS 潜在的有效疗法53。
健康肠道菌群组成可能会因营养、药物、生活方式、地理位置、压力和饮食习惯而改变。肠道菌群的失衡会影响 AD 的发生和进展。因此,使用饮食干预、益生菌和 FMT 调节肠道菌群是当前针对 AD、PD 和 MS 等各种神经系统疾病的前瞻性方法。
目前,FMT 临床应用的基本原理仍然基于少数病例报告和动物模型。越来越多的证据表明,含有患者所需细菌的胶囊对患者来说是一种更舒适的方式,未来可能会取代 FMT。为了全面了解 FMT 在神经系统疾病中的作用,我们需要进行更大规模的随机双盲试验。
参考文献
(滑动下文查看)
1.Carabotti M, Scirocco A, Maselli MA, Severi C: The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Ann Gastroenterol. 2015, 28:203-9.
2.Quigley EM: Gut bacteria in health and disease. Gastroenterol Hepatol (N Y). 2013, 9:560-9.
3.Bekkering P, Jafri I, van Overveld FJ, Rijkers GT: The intricate association between gut microbiota and development of type 1, type 2 and type 3 diabetes. Expert Rev Clin Immunol. 2013, 9:1031-41. 10.1586/1744666X.2013.848793
4.World Alzheimer Report 2015. The global impact of dementia: an analysis of prevalence, incidence, cost and trends. (2015). Accessed: June 07, 2021: https://www.alzint.org/resource/world-alzheimer-report-2015/.
5.Gaugler J, James B, Johnson T, Marin A, Weuve J: 2019 Alzheimer's disease facts and figures. Alzheimer Dement. 2019, 15:321-87. 10.1016/j.jalz.2019.01.010
6.Borody TJ, Brandt LJ, Paramsothy S: Therapeutic faecal microbiota transplantation: current status and future developments. Curr Opin Gastroenterol. 2014, 30:97-105. 10.1097/MOG.0000000000000027
7.Giovannini MG, Lana D, Traini C, Vannucchi MG: The microbiota-gut-brain axis and Alzheimer disease. From dysbiosis to neurodegeneration: focus on the central nervous system glial cells. J Clin Med. 2021, 10:2358. 10.3390/jcm10112358
8.Tiwari S, Atluri V, Kaushik A, Yndart A, Nair M: Alzheimer's disease: pathogenesis, diagnostics, and therapeutics. Int J Nanomedicine. 2019, 14:5541-54. 10.2147/IJN.S200490
9.Bulgart HR, Neczypor EW, Wold LE, Mackos AR: Microbial involvement in Alzheimer disease development and progression. Mol Neurodegener. 2020, 15:42. 10.1186/s13024-020-00378-4
10.Cenit MC, Sanz Y, Codoñer-Franch P: Influence of gut microbiota on neuropsychiatric disorders. World J Gastroenterol. 2017, 23:5486-98. 10.3748/wjg.v23.i30.5486
11.Janeiro MH, Ramírez MJ, Solas M: Dysbiosis and Alzheimer's disease: cause or treatment opportunity? [In Press]. Cell Mol Neurobiol. 2021, 10.1007/s10571-020-01024-9
12.Ganesh BP, Versalovic J: Luminal conversion and immunoregulation by probiotics. Front Pharmacol. 2015, 6:269. 10.3389/fphar.2015.00269
13.Parker A, Fonseca S, Carding SR: Gut microbes and metabolites as modulators of blood-brain barrier integrity and brain health. Gut Microbes. 2020, 11:135-57. 10.1080/19490976.2019.1638722
14.Cattaneo A, Cattane N, Galluzzi S, et al.: Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly. Neurobiol Aging. 2017, 49:60-8. 10.1016/j.neurobiolaging.2016.08.019
15.Glass P: The gut microbiome & its value in autoimmune diseases. Baylor University, Waco, TX; 2021.
16.Vogt NM, Kerby RL, Dill-McFarland KA, et al.: Gut microbiome alterations in Alzheimer's disease. Sci Rep. 2017, 7:13537. 10.1038/s41598-017-13601-y
17.Bäuerl C, Collado MC, Diaz Cuevas A, Viña J, Pérez Martínez G: Shifts in gut microbiota composition in an APP/PSS1 transgenic mouse model of Alzheimer's disease during lifespan. Lett Appl Microbiol. 2018, 66:464-71. 10.1111/lam.12882
18.Cox LM, Schafer MJ, Sohn J, Vincentini J, Weiner HL, Ginsberg SD, Blaser MJ: Calorie restriction slows age-related microbiota changes in an Alzheimer's disease model in female mice. Sci Rep. 2019, 9:17904. 10.1038/s41598-019-54187-x
19.Bonfili L, Cecarini V, Gogoi O, et al.: Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. FEBS J. 2021, 288:2836-55. 10.1111/febs.15571
20.Pistollato F, Iglesias RC, Ruiz R, et al.: Nutritional patterns associated with the maintenance of neurocognitive functions and the risk of dementia and Alzheimer's disease: a focus on human studies. Pharmacol Res. 2018, 131:32-43. 10.1016/j.phrs.2018.03.012
21.Kobayashi Y, Sugahara H, Shimada K, et al.: Therapeutic potential of Bifidobacterium breve strain A1 for preventing cognitive impairment in Alzheimer's disease. Sci Rep. 2017, 7:13510. 10.1038/s41598-017-13368-2
22.Bonfili L, Cecarini V, Berardi S, et al.: Microbiota modulation counteracts Alzheimer's disease progression influencing neuronal proteolysis and gut hormones plasma levels. Sci Rep. 2017, 7:2426. 10.1038/s41598-017-02587-2
23.Ho L, Ono K, Tsuji M, Mazzola P, Singh R, Pasinetti GM: Protective roles of intestinal microbiota derived short chain fatty acids in Alzheimer's disease-type beta-amyloid neuropathological mechanisms. Expert Rev Neurother. 2018, 18:83-90. 10.1080/14737175.2018.1400909
24.Abraham D, Feher J, Scuderi GL, et al.: Exercise and probiotics attenuate the development of Alzheimer's disease in transgenic mice: role of microbiome. Exp Gerontol. 2019, 115:122-31. 10.1016/j.exger.2018.12.005
25.Zhang F, Luo W, Shi Y, Fan Z, Ji G: Should we standardize the 1,700-year-old fecal microbiota transplantation?. Am J Gastroenterol. 2012, 107:1755. 10.1038/ajg.2012.251
26.Tetro J, Allen-Vercoe E: The human microbiome handbook. DEStech Publications, Inc., Lancaster, PA; 2016.
27.Eiseman B, Silen W, Bascom GS, Kauvar AJ: Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 1958, 44:854-9.
28.Borody TJ, George L, Andrews P, et al.: Bowel-flora alteration: a potential cure for inflammatory bowel disease and irritable bowel syndrome?. Med J Aust. 1989, 150:604. 10.5694/j.1326-5377.1989.tb136704.x
29.van Nood E, Vrieze A, Nieuwdorp M, et al.: Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013, 368:407-15. 10.1056/NEJMoa1205037
30.Bakken JS, Borody T, Brandt LJ, et al.: Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol. 2011, 9:1044-9. 10.1016/j.cgh.2011.08.014
31.Woodworth MH, Carpentieri C, Sitchenko KL, Kraft CS: Challenges in fecal donor selection and screening for fecal microbiota transplantation: a review. Gut Microbes. 2017, 8:225-37. 10.1080/19490976.2017.1286006
32.Nicco C, Paule A, Konturek P, Edeas M: From donor to patient: collection, preparation and cryopreservation of fecal samples for fecal microbiota transplantation. Diseases. 2020, 8:9. 10.3390/diseases8020009
33.Bibbò S, Settanni CR, Porcari S, Bocchino E, Ianiro G, Cammarota G, Gasbarrini A: Fecal microbiota transplantation: screening and selection to choose the optimal donor. J Clin Med. 2020, 9:1757. 10.3390/jcm9061757
34.Ianiro G, Mullish BH, Kelly CR, et al.: Screening of faecal microbiota transplant donors during the COVID-19 outbreak: suggestions for urgent updates from an international expert panel. Lancet Gastroenterol Hepatol. 2020, 5:430-2. 10.1016/S2468-1253(20)30082-0
35.Fecal transplantation for C difficile: a how-to guide. (2013). Accessed: June 07, 2021: https://www.medscape.com/viewarticle/779307.
36.Wang JW, Kuo CH, Kuo FC, et al.: Fecal microbiota transplantation: review and update. J Formos Med Assoc. 2019, 118 Suppl 1:S23-31. 10.1016/j.jfma.2018.08.011
37.Kassam Z, Lee CH, Yuan Y, Hunt RH: Fecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am J Gastroenterol. 2013, 108:500-8. 10.1038/ajg.2013.59
38.Allegretti JR, Kassam Z, Osman M, Budree S, Fischer M, Kelly CR: The 5D framework: a clinical primer for fecal microbiota transplantation to treat Clostridium difficile infection. Gastrointest Endosc. 2018, 87:18-29. 10.1016/j.gie.2017.05.036
39.Zipursky JS, Sidorsky TI, Freedman CA, Sidorsky MN, Kirkland KB: Patient attitudes toward the use of fecal microbiota transplantation in the treatment of recurrent Clostridium difficile infection. Clin Infect Dis. 2012, 55:1652-8. 10.1093/cid/cis809
40.Matsuoka K, Mizuno S, Hayashi A, Hisamatsu T, Naganuma M, Kanai T: Fecal microbiota transplantation for gastrointestinal diseases. Keio J Med. 2014, 63:69-74. 10.2302/kjm.2014-0006-RE
41.Dailey FE, Turse EP, Daglilar E, Tahan V: The dirty aspects of fecal microbiota transplantation: a review of its adverse effects and complications. Curr Opin Pharmacol. 2019, 49:29-33. 10.1016/j.coph.2019.04.008
42.Brandt LJ, Aroniadis OC, Mellow M, et al.: Long-term follow-up of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol. 2012, 107:1079-87. 10.1038/ajg.2012.60
43.Zhan G, Yang N, Li S, et al.: Abnormal gut microbiota composition contributes to cognitive dysfunction in SAMP8 mice. Aging (Albany NY). 2018, 10:1257-67. 10.18632/aging.101464
44.Yu F, Han W, Zhan G, et al.: Abnormal gut microbiota composition contributes to cognitive dysfunction in streptozotocin-induced diabetic mice. Aging (Albany NY). 2019, 11:3262-79. 10.18632/aging.101978
45.Dodiya HB, Kuntz T, Shaik SM, et al.: Sex-specific effects of microbiome perturbations on cerebral Aβ amyloidosis and microglia phenotypes. J Exp Med. 2019, 216:1542-60. 10.1084/jem.20182386
46.Fujii Y, Nguyen TT, Fujimura Y, Kameya N, Nakamura S, Arakawa K, Morita H: Fecal metabolite of a gnotobiotic mouse transplanted with gut microbiota from a patient with Alzheimer's disease. Biosci Biotechnol Biochem. 2019, 83:2144-52. 10.1080/09168451.2019.1644149
47.Sun J, Xu J, Ling Y, et al.: Fecal microbiota transplantation alleviated Alzheimer's disease-like pathogenesis in APP/PS1 transgenic mice. Transl Psychiatry. 2019, 9:189. 10.1038/s41398-019-0525-3
48.Hazan S: Rapid improvement in Alzheimer's disease symptoms following fecal microbiota transplantation: a case report. J Int Med Res. 2020, 48:300060520925930. 10.1177/0300060520925930
49.Holsinger RD, Elangovan S: Neuroprotective effects of fecal microbiota transplantation in a mouse model of Alzheimer’s disease: development of new models and analysis methods/validation of pre‐clinical methods. Alzheimer Dement. 2020, 16:e046523. 10.1002/alz.046523
50.Sun MF, Zhu YL, Zhou ZL, et al.: Neuroprotective effects of fecal microbiota transplantation on MPTP-induced Parkinson's disease mice: gut microbiota, glial reaction and TLR4/TNF-α signaling pathway. Brain Behav Immun. 2018, 70:48-60. 10.1016/j.bbi.2018.02.005
51.Zhou ZL, Jia XB, Sun MF, et al.: Neuroprotection of fasting mimicking diet on MPTP-induced Parkinson's disease mice via gut microbiota and metabolites. Neurotherapeutics. 2019, 16:741-60. 10.1007/s13311-019-00719-2
52.Makkawi S, Camara-Lemarroy C, Metz L: Fecal microbiota transplantation associated with 10 years of stability in a patient with SPMS. Neurol Neuroimmunol Neuroinflamm. 2018, 5:e459. 10.1212/NXI.0000000000000459
53. Li K, Wei S, Hu L, et al.: Protection of fecal microbiota transplantation in a mouse model of multiple sclerosis. Mediators Inflamm. 2020, 2020:2058272. 10.1155/2020/2058272
原文链接:
https://www.cureus.com/articles/63028-fecal-microbiota-transplantation-a-microbiome-modulation-technique-for-alzheimers-disease
作者|Varsha Nandwana, Shibajee Debbarma
编译 | 萌萌依
审校 | 617
编辑 | 笑咲


