
编者按:
益生菌产品广受欢迎,然而益生菌的功效却无定论。当前,关于益生菌的适应证和作用机制存在许多争议。益生菌究竟对哪些疾病具有预防和治疗效果?益生菌的功效是否依赖于成功定植?
今天,我们特别编译以色列魏茨曼科学研究院 Eran Elinav 和 Eran Segal 团队发表于 Nature Medicine 杂志上关于食用益生菌的文章。该文综述了食用益生菌对 5 种疾病的治疗有效性以及益生菌发挥作用的潜在机制,并讨论了当前益生菌所面临的挑战和解决措施等问题。希望本文能够为相关的产业人士和诸位读者带来一些帮助和启发。
几个世纪以来,人们一直都很关注口服微生物的健康益处。“益生菌”一词首次出现于 1974 年,其定义经过多番修订逐渐演变为目前的通用定义,即:当适当给予时,对宿主健康有益的活的微生物。该定义由世界粮农组织/世界卫生组织于 2002 年提出1。
如今,益生菌已经发展为一个持续增长、规模超过数十亿美元2的产业,是全世界最常用的膳食补充剂之一3。在许多常见食品中都可以看到益生菌身影,比如酸奶、奶酪、冰淇淋、零食和营养棒、早餐谷物和婴儿配方食品等。益生菌甚至还被应用于化妆品中,并且可以以胶囊药片的形式销售4。此外,益生菌的应用得到了临床医生(尤其是肠胃科医生)的广泛支持6。
尽管益生菌很受欢迎,但是几十年来关于益生菌在治疗和预防疾病方面的功效研究数据往往指向不同的结论,在许多情况下都存在矛盾、争论和困惑。
此外,欧洲食品安全局7(European food Safety Authority)和美国食品药品监督管理局8( US Food and Drug Administration)等主要医疗监管机构尚未批准任何益生菌制剂作为治疗疾病的药物。
因此,益生菌作为膳食补充剂进行销售时,往往考虑的是安全性、在胃肠道中的生存能力以及对食物味道没有影响等特性,而不是明确的健康促进作用9。这种混乱的状态亟需强有力的证据来证明益生菌对人类的益处和不利影响10。
因此,本文将重点讨论当前益生菌研究取得的进展和局限性,综述现有研究数据分析所面临的挑战,并提出可能解决上述问题的策略和方法,以及将益生菌的研究转变为可重复和高普适性且可测量的方法。
在本文中,非处方微生物干预措施都将被称为益生菌,无论其益处和有效性如何。值得一提的是,本文不包括针对各种医学适应证、非商业化的“下一代”微生物治疗方法,即活体生物药11。
本文会通过介绍一些经典研究案例,来讨论以下问题:评估益生菌健康益处研究的证据力度和临床解释方面的“已知”和未知挑战,可能的益生菌作用机制以及上述机制是否需要有效的肠道定植,益生菌与肠道菌群间的相互作用,安全性,以及未来研究方向。

几十年来,科学家、食品和制药企业对益生菌与人类健康间的关系进行了广泛的研究,形成了诸多关于益生菌具有预防疾病和治疗疾病的健康主张,如预防或治疗急性、抗生素相关和艰难梭菌相关性腹泻;改善炎症性肠病和肠易激综合征(IBS); 降低新生儿迟发性败血症和坏死性小肠结肠炎的风险。此外,还有包括消除幽门螺杆菌、减少呼吸道感染的发生率和严重程度、改善抑郁症、预防或治疗特应性皮炎以及减少与心血管疾病相关的危险因素10等健康声明。
但是,比较遗憾的是,尽管与上述健康声称相关的某些临床试验方法学质量和有效性12~16均较高,但是也有很多采用了类似研究方法却得出了阴性或者相反结论的研究,从而导致了矛盾、模糊不清和存有争议的局面。
出现上述令人困惑的情况,主要是以下事实导致的:益生菌临床试验的许多数据属于经验性临床数据,在数据收集方法、临床结局终点和分析方法严谨性方面均有一定差异性。很多研究报告使用的是定性研究方法,自报“幸福感”相关参数,如情绪或社交情况17,18。其他研究者采用了一些临床意义有限的量化标记物,例如健康个体中炎症标记物 C 反应蛋白(CRP)显著降低19,或葡萄糖耐受个体在葡萄糖刺激后胰高血糖素样肽1(GLP-1)升高20。
同样,在这些研究中所应用的系统分析方法也各不相同,包括细胞培养、体外研究、动物模型和人体研究(可能是观察性,也可能是随机安慰剂对照试验)。此外,即使在高质量的随机对照研究中,不同研究中得到的益生菌作用也可能是相互矛盾的21,22。
导致益生菌研究结论矛盾的另一个原因是菌株。目前,益生菌工业中最常使用的微生物包括乳酸杆菌属和双歧杆菌属,此外,乳球菌属、嗜热链球菌、大肠杆菌属 Nissle 1917 和布拉迪酵母也是常用微生物23。
虽然多种益生菌属和菌种某些与健康相关的作用机制是相同的(如胆盐水解酶的产生)24,但其他特性可能是菌种,甚至是菌株特异性的,或者可能需要不同菌株之间的相互作用。
为了抵消上述方法学和结果分析方法的局限性,克服以上发现的不足,研究人员和临床医生常采用系统综述和荟萃分析的形式,对多种结果进行整合。使用这些工具在揭示总体趋势方面可能非常有用。
但是,它很容易受到各个分析步骤25中可能引入的偏差的影响,例如纳入足以改变综述结论的异常结果、实验结果模棱两可或者缺乏实际结果的研究。特别是,关于益生菌的荟萃分析,有时倾向于在同一个框架下对各种不相关的微生物进行分组研究,从而导致对结果的过度或错误解读26,27。因此,即使是相似主题的荟萃分析,也有可能得出彼此矛盾的结论28,29。
因此,我们认为,荟萃分析可以作为高质量、大规模、多中心、随机对照临床试验的有效补充,但是不能完全替代临床试验。
此外,与动物模型不同,人类在饮食、年龄范围、遗传背景和肠道菌群结构方面具有高度异质性,因此对同一干预措施可能有不同的反应。事实上,多项益生菌相关研究表明精确性的重要性,因为结果差异性往往与宿主及其微生物组或饮食相关因素相关(见图 1)。在后文中,我们会进一步讨论益生菌在肠道内的定植程度具有较大的个体差异性的问题,而这可能也是导致益生菌对宿主和/或肠道菌群影响不同的原因。
最后,许多益生菌研究是由益生菌商业企业或与之密切相关的专业团队发起、资助和支持的30。虽然这一现实本身并不一定影响此类研究的有效性,但有必要通过非利益性的科学和医学机构开展的研究,对益生菌功效作用进行独立性验证。
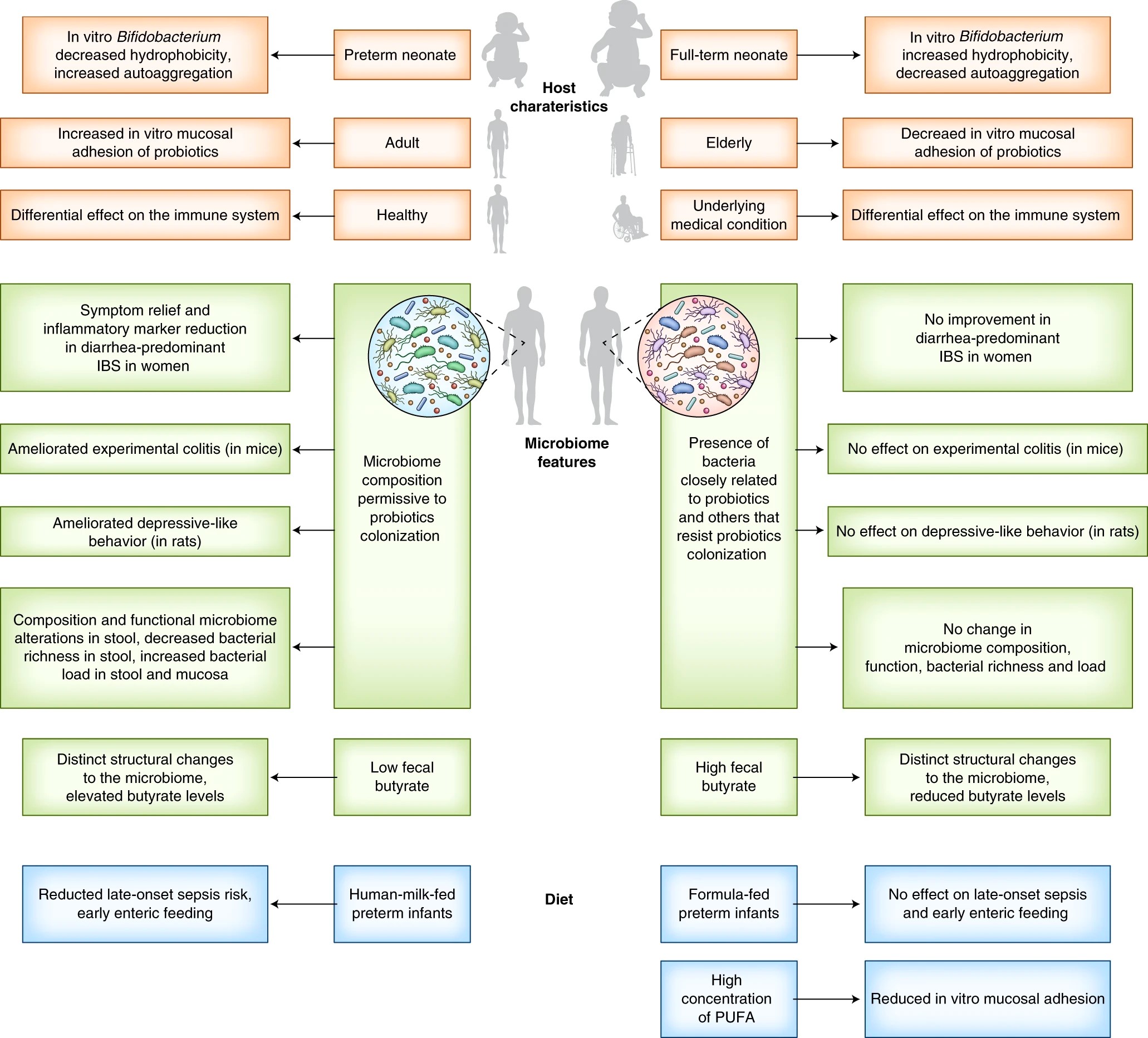
图1.益生菌的精准性
人们认为益生菌可有效预防或治疗多种儿童或成人胃肠道疾病,主要是针对急性腹泻。多项荟萃分析和系统综述结果表明,某些制剂特别是包含布拉酵母菌32、鼠李糖乳杆菌 GG(LGG)33和乳杆菌属内其他菌株34的制剂,可能会减轻儿童的急性腹泻并将其疾病发作持续时间缩短约 1 天。同时,已有研究证明益生菌可有效预防和治疗成人急性腹泻。此外,有研究表明多种制剂,特别是包含布拉酵母菌和鼠李糖乳杆菌的制剂,均可有效改善健康儿童35、成人36,37和住院患者的38抗生素相关性腹泻症状。
相反,其他研究和荟萃分析结果显示,益生菌在预防儿童39、成人21和老年人37,40的腹泻功效方面表现出不同的结果。
值得注意的是,最近两项高质量、大规模、多中心、随机安慰剂对照试验,对 1800 例急诊科急性肠胃炎儿童进行鼠李糖乳杆菌(LGG 或 R0011),添加或不添加瑞士乳杆菌 R0052 的干预试验,结果并未表现出明显的临床益处。
一项针对 4,000 多名儿童进行的早期荟萃分析结果表明,急性胃肠炎相关证据质量均较低,这导致了临床管理指南中未纳入益生菌作为治疗手段44。而另一项研究仍主张使用鼠李糖乳杆菌和布拉酵母菌,尽管这些建议所依据的证据质量比较低。
虽然科学研究结果尚存在争议,但许多人罹患肠胃炎时,会选择服用含有益生菌的“功能性食品”,进行“自我治疗”46。

住院患者接受抗生素治疗后,肠道菌群受损,这为艰难梭状芽孢杆菌在肠道进行繁殖提供了机会,并可能会导致不同严重程度的疾病,从轻度腹泻到威胁生命的假膜性结肠炎。
多项荟萃分析显示,口服益生菌具有有益效果:预防艰难梭菌感染或与其相关疾病的发病率47,尤其是在暴露于抗生素的情况下48。
2017 年对 8,672 例病例进行的荟萃分析(包括不同益生菌菌株、年龄、剂量和给药时间),发现了对于接受抗生素治疗的患者进行益生菌干预可预防艰难梭菌相关性腹泻(CDAD)的中度有益证据。但是需要注意的是,试验之间存在相当大的异质性,并且事后分析结果表明,在低和中等风险水平艰难梭菌相关性腹泻患者中,益生菌并无产生明显影响49。
另一项荟萃分析结果显示,在多种益生菌菌株中,只有布拉酵母菌对艰难梭菌有效50。然而,另有研究指出,布拉酵母菌可有效降低儿童罹患艰难梭菌相关性腹泻的风险,但是对成人无效,不过该研究的证据质量较低52。
进一步对上述荟萃分析中纳入的各项研究进行分析,结果发现大多数试验中安慰剂对照组和实验组,在试验期间未发现艰难梭菌感染(8 个试验)或发病率较低。大多数研究(34 个试验)并未得出益生菌的不同菌株具有明显改善艰难梭菌相关性腹泻或艰难梭菌感染的作用。
可能的原因是,这些研究在艰难梭菌低发病风险的情况下,本身没有足够的力度来证明益生菌干预与疗效有关。但是两项以艰难梭菌高发病风险人群为对象的随机对照试验,包括迄今为止最大的益生菌试验,在实验组和安慰剂对照组之间都并未发现明显的差异40,53。
因此,只有一小部分研究证据支持益生菌对艰难梭菌相关性腹泻具有预防作用16,38,54~57,其中有两项是未经同行评审的会议摘要58,59。 尽管在大多数研究中安慰剂对照组艰难梭菌发病率非常高,并观察到一些有益的效果16,38,54,55,57,但其他研究(艰难梭菌相关性腹泻发生率较低)的结果发现益生菌预防艰难梭菌相关性腹泻的证据水平较低30,60。
总之,不同队列研究中发生艰难梭菌相关性腹泻风险不同,对探究了不同益生菌菌株(包括真菌和细菌)的研究进行荟萃分析的研究61,或可有效解释导致研究结果差异性的原因。

肠易激综合征(Irritable bowel syndrome,IBS)是一种常见的、临床表现复杂的疾病,病因不明。对 IBS 干预措施改善效果进行评估的试验常常受到限制,这主要是因为该疾病是由主观标准定义的。因此,最重要的是确保益生菌对IBS症状的缓解不等于或低于安慰剂62。
最近的一项荟萃分析表明,益生菌可能对治疗 IBS 症状有效63,但应注意的是,没有一种单菌株制剂被证明可有效缓解腹痛、腹胀或胀气。 即使在益生菌组合中,一些被发现可有效减少症状持续时间和腹痛评分,而另一些则无效。此处强调了菌株对疾病结果的重要影响。另外,对 9 篇系统综述和 35 篇 RCT 研究进行的荟萃分析,结果并未发现各种益生菌菌株具有治疗 IBS 症状功效的证据64。
益生菌的另一个潜在功效是预防新生儿迟发性败血症和/或坏死性小肠结肠炎(Necrotizing Enterocolitis ,NEC,一种主要影响早产儿的肠胃炎)。动物模型和人类细胞培养实验表明,针对 NEC 的保护机制可能涉及抗病原体的粘膜保护,以及某些益生菌菌株(例如 LGG)诱导的先天免疫和肠道上皮细胞成熟,导致炎症反应的减弱67,68。
此外,最近发表的一项大型RCT研究也证实了上述研究结果,即对印度农村的母乳喂养婴儿(n = 4,556)口服植物乳杆菌 PP 11-217 和益生元低聚果糖混合物,具有预防新生儿败血症和死亡的保护作用12。
但是,在英国一项对 1,310 名极早产儿进行的干预试验中,在喂养婴儿的配方食品中添加了短双歧杆菌 BBG-001,结果发现对预防 NEC 或败血症没有显著作用69。
2014 年,Cochrane 发布了一份评估报告(包括 5,000 多名婴儿),其中未包括上述两项研究。评估报告指出,对早产儿进行单独的乳杆菌干预,或乳酸杆菌与双歧杆菌联合干预,可有效降低早产儿70 NEC 的发生率和死亡率,但对医院感染性败血症无效。
另一项系统评价和荟萃分析研究结果显示,益生菌发挥预防早产儿败血症有效作用的前提有两个:益生菌菌株的联合使用(与单一菌株相比)和纯母乳喂养71。两项荟萃分析报告显示,益生菌对预防极低出生体重婴儿 NEC72或败血症73发病风险无统计学意义。
因此,即使是在这种应用前景比较大的适应症中,依然需要确保足够的精确度,包括干预方式(如菌株组成、剂量、给药方式和益生元的添加方式)和患者(如与出生体重、微生物暴露相关环境因素和饮食等)。需要强调的是,关于益生菌对内源性肠道菌群及其对肠道免疫、代谢和组织器官74的长期影响,值得进一步深入研究。

多项系统评价和荟萃分析表明,益生菌可以有效降低儿童、成人、老年人甚至运动员75,76罹患普通感冒、呼吸道感染和流感样症状的严重程度、持续时间和发病率。 然而,在这些荟萃分析中,证据质量评级为低或非常低。此外,关于各项研究之间治疗效果的异质性具有重要影响。
一项纳入了儿童和成人的荟萃研究结果显示,益生菌可以降低儿童和成人呼吸道感染的严重程度和持续时间,但不能降低其发生率77。
造成研究结果差异性的原因,主要源于主观判断或间接性感染评估方式(如自我报告),或者是根据抗生素治疗持续时间或缺勤天数来推断疾病持续时间75,82。此外,差异性的原因还包括,治疗组研究对象基线水平不同(如年龄、先前感染的次数82)、无明确临床或生物学依据的二次抽样83,84,荟萃分析中无法解释排除试验标准75,以及尽管存在违反常理的剂量-反应关系,但仍将疗效归因于治疗84。
在因果关系上,非常需要直观的数据依据,来说明在胃肠道中定植的益生菌可以影响远端器官疾病的机理。
关于益生菌作用机理,一个未解决问题是,给予的益生菌是否能够在宿主胃肠道粘膜表面稳定或短暂地定植,以及它们的定植对宿主产生有益影响是否必要。益生菌菌株与肠上皮层的接触,对实现宿主-微生物相互作用可能至关重要,例如接触依赖性的免疫调节85,86,有效浓度的代谢产物分泌87和粘液层的改变88。 这场长达数十年的辩论,由两个与定植有关的问题组成,下面将分别进行讨论。
1.补充过程中的肠道粘膜定植
在进食期间补充益生菌,菌群会在肠道粘膜上定植吗?令人惊讶的是,直到最近,这一极其重要的课题才在人类身上得到全面的直接探讨。
大多数关于益生菌定植的说法,都是通过对粪便中益生菌菌种丰度的评估推断出来的,而没有直接检查这是否真的反映了它们的定植能力,还是仅仅是微生物通过胃肠道直接排泄到了粪便中89。与粪便评估一样,由于在体外环境中缺乏大量的宿主和微生物因素,在体外实验中益生菌粘附在人胃肠道细胞上的研究90,91,对于体内定植来说可能并不是最佳证明。
在少数试验中可以通过内窥镜检查对粘膜益生菌定植直接定量,包括人群试验92~95和猪动物实验96,97。其中一些研究表明,在补充期间甚至在补充益生菌之后,可以从受试对象的胃肠道器官中分离出益生菌,而其他研究则显示出高度有限的和可变的定植模式,且仅在少数受试个体中可以观察到98~101。
值得注意的是,在上述研究中,通过培养或 16S rDNA 技术对益生菌定植情况进行评估,大大限制了补充的益生菌菌株和与益生菌密切相关且属于同一物种和/或属的内源性共生菌的可分辨性(见 Box1)。
利用结肠镜检查和胃镜检查技术,对食用 11 种益生菌菌株(属于 4 种应用广泛益生菌属)的受试者进行菌种和菌株敏感性的宏基因组学评估89,结果发现食用益生菌菌株后,约 60%个体粘膜出现相关益生菌;使用超灵敏 qPCR 测定结果发现,其余 40%受试者细菌定植抗性相近。
粘膜结合程度与粪便中益生菌菌株的丰度无关,但可以通过宿主和菌群因素的基线水平组合来预测,这凸显了个性化益生菌的潜在未来前景。有趣的是,将“抗性”或“可定植”人群粪便菌群移植到无菌(GF)小鼠中,再现了供体对益生菌定植的易感性,表明存在优势菌群介导的定植抗性机制89。
非定植依赖性益生菌可能对宿主有影响,如对食物消化的影响,但需要实验证据。鉴于此,在上述研究89中,即便是在积极补充益生菌期间,“抗性”个体肠腔102中依然未检测到益生菌菌株,这表明暂时和/或持续定植的粘膜相关益生菌可能是肠腔细菌的重要贮藏库。
停止食用后,益生菌是否仍会在肠道粘膜上持续定植?即使在允许定植的个体中,益生菌的定植是否在补充停止后持续,仍然不清楚。
在喂食含有 5 种益生菌菌株的发酵乳制品(FMP)的大鼠实验中,发现在喂食期间所有大鼠粪便中都检测到补充的菌株,但只有一部分大鼠在补充停止后 2 天,继续检测到这些菌株(5 种益生菌菌株中的一种,为乳酸乳球菌 CNCM I-1631)。将可定植和抗性大鼠的肠道菌群移植到无菌大鼠中,可以重复供体的定植性103。
在接受益生菌补充剂的人群中,有研究报告显示,与其他菌种干预实验相比 113,随着饮食中婴儿双歧杆菌 35624104、动物双歧杆菌乳酸菌 Bb-12105、嗜酸乳杆菌 R52106、干酪乳杆菌 DN-114 001107、约翰逊乳杆菌 La1101,108、植物乳杆菌299v109、罗伊氏乳杆菌 DSM17938110,111、鼠李糖乳杆菌(LGG,R11,19070-2)100,106,111和唾液乳杆菌 CECT5713112等干预期的结束,粪便中益生菌含量水平也逐渐降低。但是,在大多数研究中,干预结束后随访时间仅持续了 1~2 周。
在长时间随访研究中得到的结果表明,存在菌株和个体特有的持久变异性。停止益生菌干预后两个月,十个人中只有一位受试者体内检测到鼠李糖乳杆菌114;然而服用长双歧杆菌 AH1206 的消费者中,在停止益生菌服用 6 个月后,依然有近 1/3 受试者粪便中检测到了益生菌菌株115。
对摄入同时添加了上述 5 种菌株的发酵乳产品后,研究发现停止干预后五周,粪便样品中仅检测到乳酸杆菌 CNCM I-1631,同时只有一部分个体在补充前菌群组成不同于非携带者103。
Box 1 | 益生菌研究相关微生物组学分析策略
微生物组学研究领域的进展,为益生菌与常驻微生物群落之间的相互作用提供了一个全新的解决方案,同时可有效避免以往方法的局限性和差异性,以解决出现相互矛盾结果的局面。
造成这种混乱局面的主要原因是,对“微生物组改变”的定义很宽泛。大多数研究都是利用粪便样本中的 16S rDNA 相对丰度(RA),来评估益生菌对菌群的调节作用。当补充的益生菌随粪便排泄后,其相对丰度(RA)的增加,有时可能是由于其他群落成员206的相对丰度(而非绝对丰度)降低导致的,但却被错误地解释为菌群改变207。同样,热灭活细菌的引入,有助于将其遗传物质添加到样本中,从而影响相对丰度208。
因此,干预益生菌菌株的相对丰度的升高,不应解释为对微生物组的有益作用209。
基于 16S rDNA 分析的另一个重要局限性在于,无法对干预益生菌菌株和同一物种内源性菌株进行区分,导致补充菌株丰度相对增加,此现象可能会被误当作内源性菌株恢复209。利用培养技术或物种特异性探针技术211,通过对益生菌绝对丰度的测量,可有效避免上述问题,同时还可探究补充性益生菌菌株的变异情况212。
但是与 16S rDNA 分析技术不同,培养技术或物种特异性探针技术无法对益生菌干预前和干预后的菌群构型、β 多样性和 α 多样性等整体变化情况进行描述分析。然而宏基因组测序技术得出的结果也有可能是相互矛盾的213,214,尽管它具有菌株级分辨率优势,可有效鉴定益生菌对微生物组功能的潜在作用。
有趣的是,一些研究报告了益生菌相关的基因、途径或微生物代谢物对微生物组功能的影响,尽管微生物组的功能性改变可能是补充益生菌菌株的基因产物导致的,而不是微生物群落改变的结果115,215,216。
另一个限制因素是人们对 “健康微生物组”的定义(益生菌可能是该定义的一部分)。这一定义即使在评估与益生菌相关的微生物组调节作用研究时,也无法达成相关共识。而且在多数情况下,益生菌引起的微生物组变化的报道也相互矛盾。
例如,产气荚膜梭菌208,211,212或大肠埃希氏菌212,217,218以及各种临床环境174都属于这种情况。举个例子,在炎症性肠病患者中发现,粪便中益生菌相关性产丁酸盐性细菌(主要是梭状芽孢杆菌)相对丰度增加,嗜双歧杆菌和对羟基苯甲酸杆菌相对丰度降低。在另一项益生菌(B.wadsworthia)干预队列(n=107)研究中,得到了相似的实验结果,实验对象临床症状得到明显改善202。然而,该研究结果并未在 RCT(n=55)研究219中得到复现。
重要的是,即使益生菌干预与菌群变化具有相关关系,也需要注意这些变化可能源于疾病本身的调控作用,而非源于对益生菌的暴露。迄今为止,尚未有研究证明益生菌相关微生物组调节与疾病表型变化具有直接因果关系。
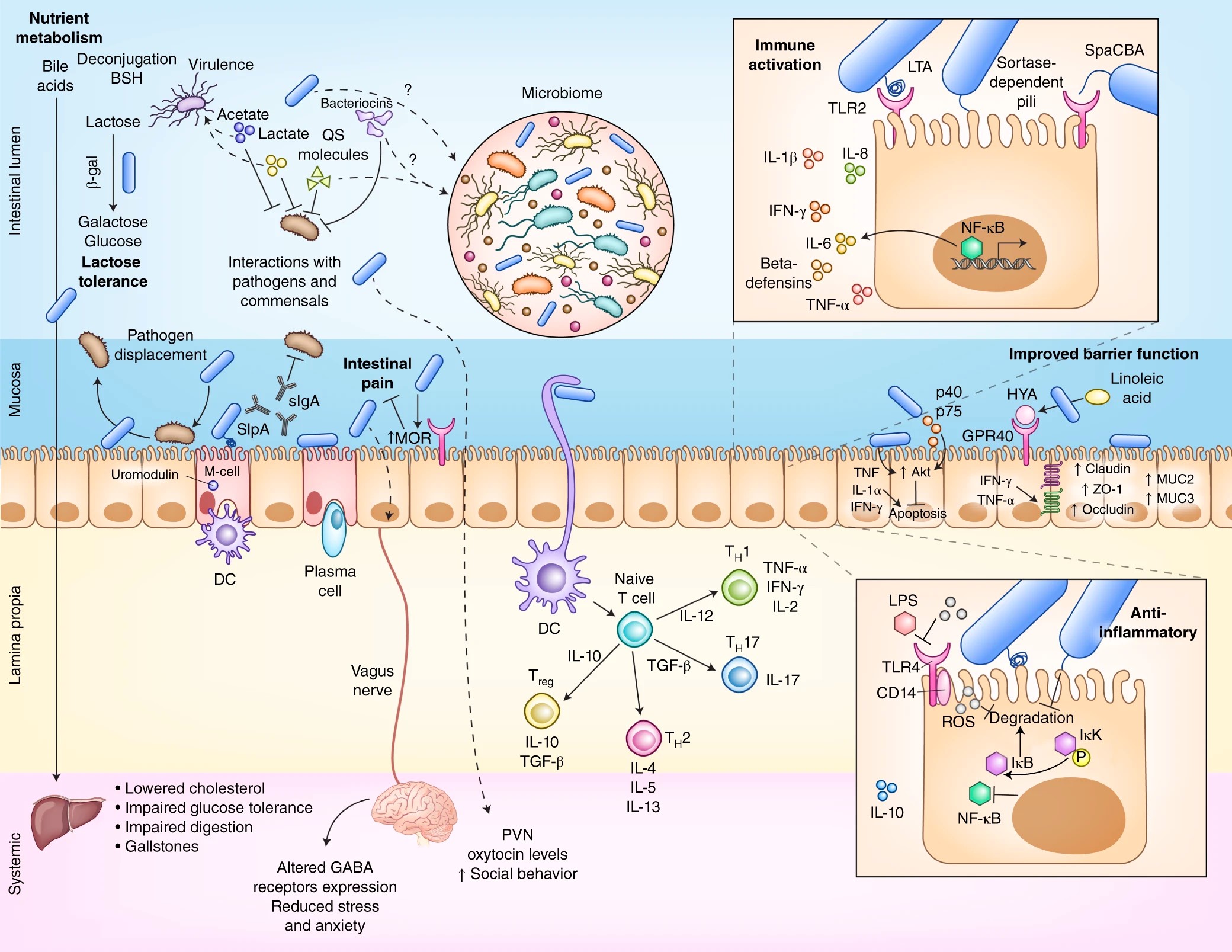
图 2. 益生菌与宿主及其微生物组之间的机制相互作用。
研究人员认为,益生菌的有益作用是通过多种机制实现的,包括诱导免疫调节、生理应激保护、抑制病原体、调节微生物组以及改善肠上皮的屏障功能(见图 2)。
这些机制研究往往受限于以下几个方面:对细胞培养系统的依赖性太重,往往会忽略胃肠道粘膜微生态环境中微生物与微生物、微生物与宿主之间相互作用的生理性线索。因此,这些实验往往无法在体内实验中复现。
另一个局限性源于,外源性“人类相容性”益生菌在小鼠胃肠粘膜中的定植能力比在人体内定植能力差89,116。
宿主之间的差异性可能在功能性上有一定的意义,因为与自身携带菌群的小鼠相比,给小鼠移植人类菌群,会对宿主免疫系统117,118或宿主代谢组119产生明显不同的效果。
值得注意的是,一些益生菌特性同时具有菌种和菌属差异,如双歧杆菌和乳酸杆菌都会产生 β-半乳糖苷酶,可以弥补乳糖酶功能不足120,121。而其他性状可能是由菌种特异性122或菌株特异性123引起的,或者是益生菌菌株之间的相互作用124,还需要进一步讨论。
多项研究表明,益生菌可影响免疫相关基因的表达、抗炎途径活性和免疫标记物水平,通过调节肠上皮细胞 NF-κB、促分裂原活化蛋白激酶(MAPK)、Akt(也称为磷酸肌醇-3-激酶,PI3K),过氧化物酶体增殖物激活受体-γ、CRP、白介素(IL-6、IL-8)、肿瘤坏死因子 TNF-α、IL-1β 和干扰素 γ(IFN-γ)调节作用125等多种依赖于接触的机制。
有趣的是,在一些研究中发现,活菌和死菌对基因表达有不同的影响。结果表明,微生物细胞表面和活性分泌分子都可能影响肠道转录组126。
关于益生菌对宿主免疫影响的其他示例包括:乳酸杆菌介导的 toll 样受体 2(TLR2),通过脂磷壁酸(LTA)127对 TNF-α 分泌的依赖性刺激;长双歧杆菌介导的接触依赖性 IL-10 分泌128;类胰蛋白酶依赖的双歧杆菌菌毛引起的 TNF-α 反应90;长双歧杆菌 36524 中的细胞表面胞外多糖(sEPS)调节肠道和肺中的促炎细胞因子和辅助性 T 细胞 17(TH17)反应129;鼠李糖乳杆菌中的免疫刺激细胞表面附属物(SpaCBA)的介导作用(体外)——与人肠粘液的结合以及 TNF-α、IL-6、IL-10 和 IL-12 的 TLR2 依赖性调节130。
体内作用机制的其他示例还包括:LGG 诱导活性氧的产生,以及随后通过 SpaC 介导的肠上皮粘附作用131,以抑制 TNF-α 诱导的肠 NF-κB 活化作用;唾液乳杆菌 Ls33(不是嗜酸乳杆菌 NCFM)的肽聚糖,以核苷酸结合寡聚化结构域(NOD2)–IL-10-依赖性的方式,保护小鼠免受化学性结肠炎的侵害122;嗜酸乳杆菌 L-92 与 microfold 细胞(M细胞)结合,引发其表面蛋白 A(SlpA)的免疫调节作用132;婴儿芽孢杆菌 35624 诱导人 TLR2 依赖性 T 调节细胞133;动物乳杆菌 Bb-12 诱导 IgA 的分泌134,135。
综上所述,多数研究均表明,宿主细胞和益生菌之间需要有一定的物理接触或接近,以发挥促炎和抗炎反应的潜在诱导作用,这突出了益生菌干预环境的重要性。在定植的个体中观察到以上变化的临床结果,无论是否有益,都值得进一步人体试验研究。

有人认为益生菌主要是通过附着在上皮细胞和物理阻断病原体的粘附能力,来抑制病原体的定植。上述理论也在细胞培养136,和在小鼠体内检测沙门氏菌和嗜酸乳杆菌 LAP5 或发酵乳杆菌 LF33 137的实验中有所体现。
嗜酸乳杆菌 A4 可以通过上调粘蛋白 2(MUC2)、IL-8、IL-1β 和 TNF-α 表达水平,来拮抗大肠杆菌 O157:H7 对肠上皮细胞的粘附作用138。有研究显示,多种双歧杆菌属菌株可在体内产生乙酸盐,通过调节环境酸度等相关作用机制,从而抑制产生志贺毒素的大肠杆菌 O157:H7 的表达137。多种乳酸菌可以产生细菌素,从而发挥抗菌活性作用140。例如,唾液乳杆菌 UCC118 产生的 Abp118 细菌素,可保护小鼠免受单核细胞增生李斯特菌感染141。
其他作用机制可能涉及细菌群体感应(Quorum Sensing,QS)的中断。例如,嗜酸乳杆菌 La-5 在体外抑制了大肠杆菌 O157:H7 的自诱导因子-2(AI-2)和某些毒力因子的表达142;嗜酸乳杆菌 GP1B 在体外抑制了艰难梭菌的自诱导因子-2(AI-2)活性,对感染艰难梭菌的小鼠施用嗜酸乳杆菌 GP1B,可明显提高其存活率143;罗伊氏乳杆菌 RC-14 产生介体因子,通过干扰金黄色葡萄球菌细菌群体感应,从而抑制其毒力(包括毒性休克综合征毒素-1 的表达)144。
重要的是,QS 分子的产生和对 QS 信号产生响应,是病原菌和共生菌共有的特征145。因此,体内 QS 信号的复杂程度和响应者的丰度,可能与体外实验有所差别146。此外,QS 甚至可以抑制体内共生细菌147的生长。
关于益生菌改善肠道屏障功能潜在的机制作用已被提出,并在其他文献中作了综述148。主要包括上调紧密连接(TJ)蛋白(包括 claudin-1,occludin 和 ZO-1)表达水平、改善跨上皮电阻(TEER)、促进粘液分泌(通过上调结肠上皮细胞中 MUC2,MUC3 和 MUC1 表达水平)、促进丁酸盐分泌以及对菌群组成的调节。
上述作用可能是通过介导局部代谢产物的分泌来完成的。例如,植物乳杆菌产生的羟基-顺式-12-十八碳烯酸(HYA),已被证明可通过 G-蛋白偶联受体(GPR)-40-丝裂原活化蛋白激酶(MEK)-细胞外信号调节激酶(ERK)149途径调节 TNF 受体 2 的表达,抑制紧密连接蛋白的通透性以及 IFN-γ 和 TNF-α 诱导的 occludin、ZO-1 和 claudin-1 的下调。
特应性皮炎小鼠模型的研究表明,HYA 可降低小鼠皮肤 TNF-α 水平和增加 claudin-1 水平150,并通过 GPR40 依赖性方式,改善病原体诱导的牙龈上皮屏障受损151。
有学者认为,从 LGG 中纯化的两种分泌蛋白(分别称为 p40 和 p75),可通过抑制细胞因子诱导的上皮细胞凋亡,来维持肠上皮的内稳态152。
其他作用机制可能需要直接粘附在细胞粘膜上,如乳酸杆菌菌株在 HT29 细胞153中诱导的 MUC3 表达,以及在 Caco-2 细胞88中诱导 MUC2 表达。对于粘附性的需求,可能解释了为什么在体内补充普通商用 VSL#3 益生菌混合物,会导致关于增加粘蛋白分泌能力相互矛盾的结果。
需要强调的是,当研究人员试图在临床试验中验证上述研究发现时,往往无法得出定论。在某些试验中,可以观察到益生菌对多种潜在疾病具有明显的改善作用156~158,而在其他试验159~162中则未观察到任何有益作用。这些差异是否代表了早期研究不重视益生菌的定植作用,仍有待确认。

商用益生菌的先决条件之一是抵抗胆汁盐介导的生长抑制。例如,乳酸杆菌和双歧杆菌通过产生胆盐水解酶(BSH)来抵抗胆汁。其中胆盐水解酶可从类固醇核心基团上解离释放出甘氨酸或牛磺酸24。胆盐水解酶的活性与机体的有益代谢作用有关,包括减少小鼠体重增加、降低血浆胆固醇和肝脏甘油三酯水平163,还可以降低人体胆固醇水平164。然而,胆汁酸的解离,可能导致机体对膳食脂肪的消化不良和胆结石的形成以及葡萄糖耐量降低165。
有学者提出,益生菌可通过肠-脑轴中枢神经系统信号传导,帮助宿主抵抗焦虑、抑郁和伤害等作用166。喂食鼠李糖乳杆菌 JB-1 的小鼠,其大脑中 γ-氨基丁酸 A 受体(GABA-A)和 γ-氨基丁酸 B 受体(GABA-B)mRNA 的表达出现特定区域性变化,这可能与皮质酮对应激和焦虑相关行为的反应减弱有关,在迷走神经切断的动物中未观察到167相关变化。
尽管如此,同样的菌株对调节人类压力和认知能力则无效168。在小鼠实验中(即将益生菌移植到无菌小鼠中),母体高脂肪饮食会导致母鼠和子代肠道菌群失调,并且造成子代社会行为异常。
用罗伊氏乳杆菌 ATCC PTA 6475(注意:不是约翰逊氏乳杆菌 ATCC 33200)对高脂肪饮食母体进行干预,结果显示其可恢复母体降低的室旁核催产素水平,并有效改善社交行为169。在大鼠实验中发现,罗伊氏乳杆菌 DSM 17938 还可能以瞬时受体电位类香草素 1(TRPV1)依赖性的方式170,表现出抗伤害作用。同时,在大鼠实验中还发现,嗜酸乳杆菌 NCFM 可诱导肠道上皮细胞中 μ 阿片受体和大麻素受体的表达,发挥镇痛作用171。
需要注意的是,正如最近有关益生菌对焦虑影响的荟萃分析结果一样172,在动物模型中产生的明显健康效应,不一定能转化为人类健康益处。因此,尽管有研究表明益生菌具有显著影响肠脑轴的潜在作用,但是人们还未发现其中关键作用分子,如何将动物模型中的有益发现转化为对人类有效的治疗方法至关重要。
虽然益生菌对宿主的影响,不一定与宿主内源性微生物组的相互作用有关,但是益生菌的引入通常与“有助于调节肠道菌群组成和恢复肠道菌群失调”等健康声称相关联——既可以作为机体自身菌群健康的有利因素,也可以作为益生菌保护宿主免受疾病侵害的机制1。
尽管如此,益生菌对健康人群肠道菌群能发挥多大的调节作用(如果有的话)仍然存在争议。2015 年的一项系统性综述突出强调了这一点,该综述报告的 7 项研究中有 6 项研究缺乏益生菌对宿主菌群影响的证据173。另一项更早的系统性综述,对不同试验中所使用的益生菌进行了分析,发现其中只有 21%发生了菌群的改变174。需要注意的是,对宿主菌群的假定影响可能源于分析偏差(见 box 1),而表征益生菌对胃肠道菌群原位影响的试验很少(见 box 2)。
可能影响益生菌调节微生物组能力的一个重要决定因素,就是采取益生菌干预之前,肠道的内源性微生物环境可能具有较大的个体差异性。抗生素对微生物组175具有极大的干扰性,可以减轻对益生菌116和病原菌176的定植抗性。在使用抗生素情况下,认为益生菌会占据空置的生态位,并可防止病原体定植和与抗生素相关的腹泻35,或纠正与抗生素相关的营养不良1。
但是,支持益生菌在抗生素干扰后,可促进肠道微生物组重建的能力的证据,通常是基于细菌培养物或特异性荧光原位杂交或 qPCR 探针。它们只能代表干扰微生物组的极小一部分,即使使用这种方法,研究结果中所发现的菌群失调修复作用可能依然是片面的177,178或作用甚微179,并备受争议174。
综上所述,除了干预菌株、剂量和持续时间或微生物组分析方法173,174,180,食用期间益生菌菌株本身可能会短暂存在之外,大多数研究不支持益生菌在组成或功能上具有微生物组调控作用。在报告益生菌相关微生物组改变的研究中,很难指出常见的微生物变化模式是什么。尽管有些研究报道了微生物组改变与健康促进作用是同时发生的,但没有一项研究显示出两者之间具有因果关系。因此,迄今为止还不可能先验地宣称这种微生物组改变是有益的。
尽管粪便样本可能无法准确代表胃肠粘膜粘附的微生物组220,但只有少数研究表征了益生菌对肠道微生物组的原位影响。
对接受植物乳杆菌 299v 菌株干预的个体(n=29)进行菌株培养实验,研究结果表明,粪便样本中梭状芽胞杆菌呈现富集现象,但直肠或升结肠粘膜中梭状芽胞杆菌并未出现富集现象99。同样,通过与自身基线水平或对照组个体相比,接受益生菌干预人群下消化道管腔或粘膜上微生物组成,并未发生明显的改变89。
在大鼠中,VSL#3 加剧了与化学性结肠炎诱导相关的管腔菌群物种多样性的减少,但对粘膜相关微生物组无明显影响221。相反,在结肠炎相关结直肠癌的小鼠模型(经偶氮甲烷处理的 II10-/-小鼠)中,补充 VSL#3 导致变形杆菌的粘膜扩张和疣状芽胞杆菌科、卟啉菌科和梭状芽胞杆菌的减少,这些变化会促进肿瘤的发生发展222。
在罹患贮袋炎患者中,也观察到了益生菌相关微生物调节作用的相互矛盾性结果,尽管研究中相关变化仅仅是由于将 VSL#3 引入生态位导致的223。
虽然益生菌在治疗或预防疾病作用功效的争论持续了数十年,但通常认为人类补充益生菌是安全的,同时大多数益生菌菌株获得了监管机构的安全性认可181。这一安全性认可,主要是基于食品中益生菌的安全使用历史和临床试验中观察到健康疗效,而不是以安全性为主要指标的观察结果4。
虽然益生菌在健康成人中的应用可能是安全的,但在婴儿182和极低出生体重新生儿183中使用益生菌,可能会增加感染和/或死亡风险;在重症监护病房的重症成年和婴儿以及术后、住院或免疫功能低下患者,感染和/或死亡风险增加的部分原因可能是菌血症和真菌感染35,184~186。
尽管如此,除了益生菌菌株本身作为病原体引起的血液感染试验之外,益生菌使用与感染风险增加之间的这种因果关系仍有待验证。值得注意的是,对数百项益生菌试验进行的两项大规模系统综述结论发现,关于不良事件和安全性问题报道并不多187,188,在此呼吁开展非行业赞助、独立、高质量、多中心对照试验,来完成对负面临床疗效的评估以及对上述高危人群不利影响的评估,最好结合监管机构的评估189。
有趣的是,对人类个体进行抗生素治疗后,益生菌菌株在结肠的定植增加,与长期持续的益生菌诱导性菌群失调相关116。与未进行抗生素干预组相比,粪便和胃肠道粘膜菌群重建进程出现显著延迟。干预性乳酸杆菌菌株所分泌的可溶性因子,可直接抑制(至少在体外)人类菌群的生长116。
另外两项实验也得出了相似的结论。与未进行益生菌治疗组相比,对个体进行抗生素治疗后,益生菌补充与肠道微生物组中观察到的物种数量相关190,191;另外一项研究结果192显示,与安慰剂组相比,益生菌对抗生素治疗后微生物群 α 和 β 多样性没有显著影响。
值得注意的是,在使用抗生素时,抑制菌群重建,可能会对健康产生长期显著的影响。长期菌群失调可能阻碍菌群对致病性真菌的定植抗性,这可能可以解释,采用抗生素治疗后个体使用益生菌和传染病风险增加间的关系35,183,185,193~195,如 1 型和 2 型糖尿病、肥胖症、特发性关节炎、哮喘、过敏和炎症性肠病176。
基于上述研究的观察结果,我们认为,在未来的临床试验中,为了更好地评估益生菌对儿童、免疫缺陷患者和危重患者食用益生菌的安全性,关注益生菌的长期作用效果是至关重要的。
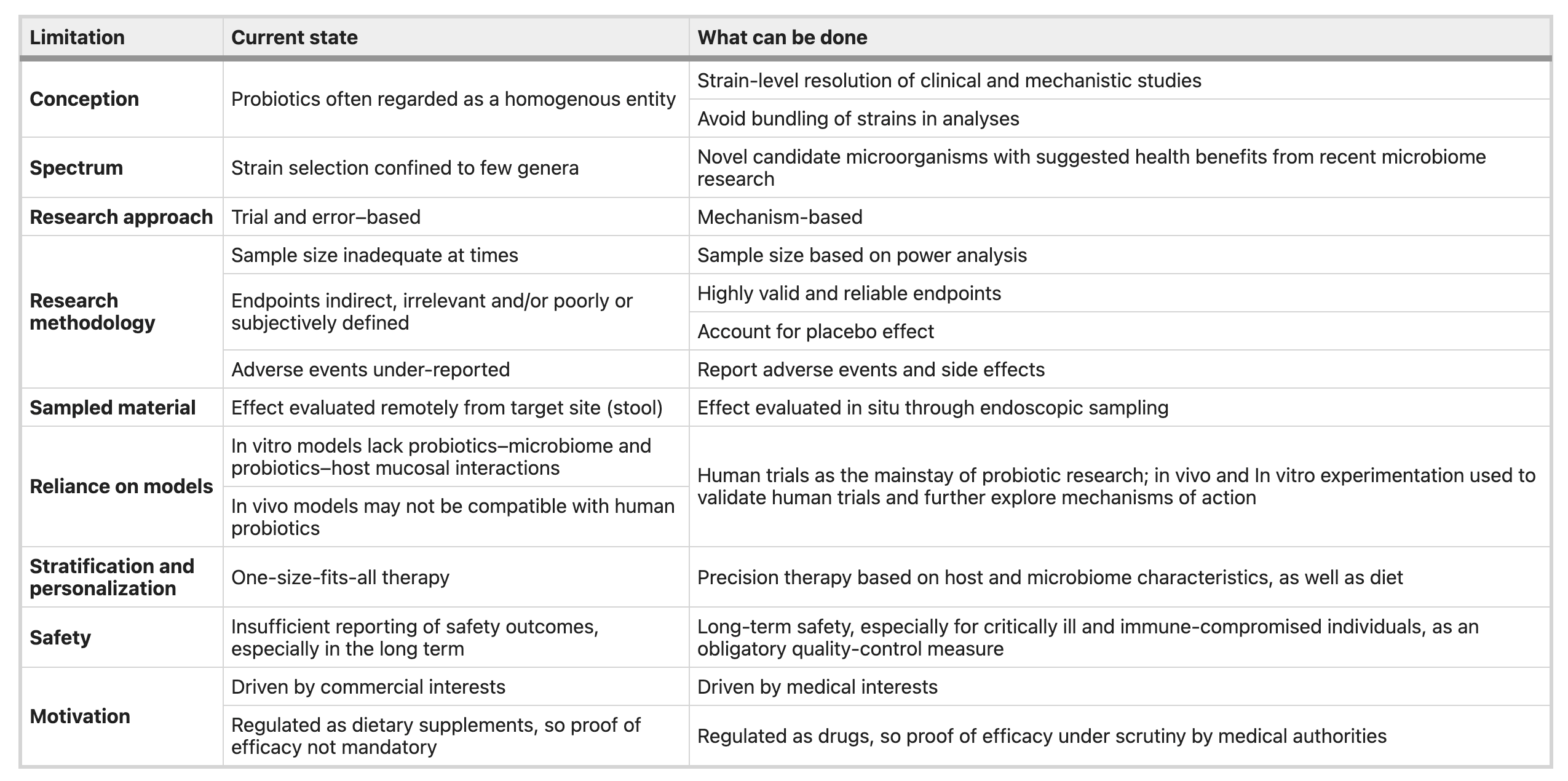
表1. 益生菌研究领域注意事项及相关解决方案
益生菌研究数据、个人立场、证据强度、直观感觉和商业利益,加上缺乏足够的医疗监管,种种因素混杂在一起,使得对实验结果进行客观解释变得几乎不可能。尽管可能存在这种不幸的情况,但我们认为,微生物组学领域的最新发现以及高通量测序和实验技术的引入,有助于研究者们对益生菌的一些基本概念进行重新审视,并将重点放在生物学相关的问题上,以促进从经验性到临床、疾病和患者导向性疗法的转变(见表 1)。
这也就意味着以机制为导向的方法要取代“黑箱”操作方法,即不是随意采用一个或多个有限的细菌组合,而是精心筛选出可以促进健康的组合。并根据精心制定的标准,完成益生菌制剂的设计。
其中需要重点关注的内容是,目标人群及临床适应症。微生物治疗的目的同样也需要仔细确认,并应该考虑一系列相关问题。
对宿主的影响是通过外源性细菌分泌分子、调节内源性菌群,还是通过其他假定的接触依赖性机制,将这些细菌与肠上皮细胞相连并实现远程或间接介导的?预期的益生菌效应是菌株特异性的,还是由许多益生菌菌株共有的?一种非食品级的菌株是否适合处理特定临床适应证?
例如,在小鼠中补充 Akk 菌,可以预防饮食诱导的代谢综合征,并防止化学诱导性结肠炎11。Fecalibaterium prausnitzii 与克罗恩病活动性、IBS和结直肠癌呈负相关,可有效保护小鼠免受化学诱导的结肠炎11的侵袭。
作为目前可及的商用益生菌,在充分考虑消费者安全的情况下,强化对宿主与常驻微生物组和潜在新型益生元微生物之间相互作用的认识,是至关重要的。
高效的益生菌治疗,可能需要开发解决菌群定植抗性的方法。这可以通过对宿主基线水平和微生物组特征89,103,115,116建立预测模型,来评估菌群的定植能力,同时需要对患者进行分层治疗196或生成个性化的菌群组合。其他方法可能包括合理联合使用“益生元”12、定植修饰剂197或耐药菌株特异性药物198或对抗共生体抑制机制。
益生菌的副作用——抗生素使用条件下对宿主转录组和菌群重建的不利影响,需要综合更多抗生素方案和益生菌菌株组合并进行全面的评估,通过将人类微生物组转移到无菌小鼠中进行建模,以评估益生菌可能导致的营养不良等潜在长期临床后果。
但是,在使用抗生素后的环境下,与益生菌相关菌群失调可能在其他临床环境中具有积极作用。抗生素引起的“无生态位释放”会明显改善益生菌定植,并通过允许益生菌在多种菌群紊乱相关的疾病状态下定植,从而增强益生菌功能。
从经验上的“一刀切”方案转变为更具针对性的方法,必然需要更好地理解影响外源性细菌定植的因素和人-肠粘膜的定植抗力。但是,在兼顾消费者安全的同时,利用特定菌株、特定人类亚群和特定临床环境产生的结果,将会更可靠,并且重复性会更高。
最后,精心规划的大规模随机和盲法临床试验,应该优先考虑纳入那些缺乏商业利益的研究,并将其作为循证依据制定的主体。应当对研究终点进行客观和分层评估,以平衡可能造成掩盖效应、结局混淆或不良结果的差异。
需要重视对不良反应研究、报告和发表。应鼓励临床医生和消费者进行无偏见的风险和收益评估,以提高在各种临床环境下数据的准确性,并驱动决策的制定。保证数据的可获得性和共享性,有效促进全球协作,以产生积极成果。鉴于目前对现有益生菌缺乏足够的医疗监管,与其他任何人类医学干预措施一样,在此更需强调下一代益生菌使用时需获得正式监管批准程序的重要性。
参考文献:
(滑动下文查看)
1.Hill, C. et al. Expert consensus document. Te International Scientifc Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol.11, 506–514 (2014).
2.Global Probiotic Market Is Set For Rapid Growth and is Expected To Reach Value Around USD 65.87 Billion by 2024 (Zion Market Research, 2018).
3.Clarke, T. C., Black, L. I., Stussman, B. J., Barnes, P. M. & Nahin, R. L.Trends in the use of complementary health approaches among adults:United States, 2002–2012. Natl. Health Stat. Report. 79, 1–16 (2015).
4.Hofmann, D. E. et al. Probiotics: achieving a better regulatory ft. Food Drug Law J. 69, 237–272 (2014).
5.Draper, K., Ley, C. & Parsonnet, J. Probiotic guidelines and physician practice: a cross-sectional survey and overview of the literature. Benef.Microbes 8, 507–519 (2017).
6.Williams, M. D., Ha, C. Y. & Ciorba, M. A. Probiotics as therapy in gastroenterology: a study of physician opinions and recommendations.J. Clin. Gastroenterol. 44, 631–636 (2010).
7.Rijkers, G. T. et al. Health benefts and health claims of probiotics: bridging science and marketing. Br. J. Nutr. 106, 1291–1296 (2011).
8.Saldanha, L. G. US Food and Drug Administration regulations governing label claims for food products, including probiotics. Clin. Infect. Dis. 46,S119–121 (2008).
9.Degnan, F. H. Clinical studies involving probiotics: when FDA’s investigational new drug rubric applies-and when it may not. Gut Microbes 3, 485–489 (2012).
10.Snifen, J. C., McFarland, L. V., Evans, C. T. & Goldstein, E. J. C. Choosing an appropriate probiotic product for your patient: an evidence-based practical guide. PLoS One 13, e0209205 (2018).
11.El Hage, R., Hernandez-Sanabria, E. & Van de Wiele, T. Emerging trends in “smart probiotics”: functional consideration for the development of novel health and industrial applications. Front. Microbiol. 8,1889 (2017).
12.Panigrahi, P. et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature 548, 407–412 (2017).
13.Kruis, W. et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as efective as with standard mesalazine.Gut 53, 1617–1623 (2004).
14.Canani, R. B. et al. Probiotics for treatment of acute diarrhoea in children:randomised clinical trial of fve diferent preparations. Br. Med. J. 335,340 (2007).
15.Ruszczyński, M., Radzikowski, A. & Szajewska, H. Clinical trial:efectiveness of Lactobacillus rhamnosus (strains E/N, Oxy and Pen) in the prevention of antibiotic-associated diarrhoea in children. Aliment.Pharmacol. Ter. 28, 154–161 (2008).
16.Gao, X. W., Mubasher, M., Fang, C. Y., Reifer, C. & Miller, L. E. Dose–response efcacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difcile–associated diarrhea prophylaxis in adult patients. Am. J. Gastroenterol. 105, 1636–1641 (2010).
17.Fujimori, S. et al. A randomized controlled trial on the efcacy of synbiotic versus probiotic or prebiotic treatment to improve the quality of life in patients with ulcerative colitis. Nutrition 25, 520–525 (2009).
18.Benton, D., Williams, C. & Brown, A. Impact of consuming a milk drink containing a probiotic on mood and cognition. Eur. J. Clin. Nutr. 61,355–361 (2007).
19.Kekkonen, R. A. et al. Probiotic intervention has strain-specifc antiinfammatory efects in healthy adults. World J.Gastroenterol. 14,2029–2036 (2008).
20.Simon, M. C. et al. Intake of Lactobacillus reuteri improves incretin and insulin secretion in glucose-tolerant humans: a proof of concept. Diabetes Care 38, 1827–1834 (2015).
21.Pereg, D. et al. Te efect of fermented yogurt on the prevention of diarrhea in a healthy adult population. Am. J. Infect. Control 33, 122–125 (2005).
22.Dietrich, C. G., Kottmann, T. & Alavi, M. Commercially available probiotic drinks containing Lactobacillus casei DN-114001 reduce antibioticassociated diarrhea. World J. Gastroenterol. 20, 15837–15844 (2014).
23.Gareau, M. G., Sherman, P. M. & Walker, W. A. Probiotics and the gut microbiota in intestinal health and disease. Nat. Rev. Gastroenterol. Hepatol.7, 503–514 (2010).
24.Begley, M., Hill, C. & Gahan, C. G. Bile salt hydrolase activity in probiotics.Appl. Environ. Microbiol. 72, 1729–1738 (2006).
25.de Vrieze, J. Te metawars. Science 361, 1184–1188 (2018). 26.Moayyedi, P. et al. Te efcacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut 59, 325–332 (2010).
27.Shimizu, M., Hashiguchi, M., Shiga, T., Tamura, H. O. & Mochizuki, M.Meta-analysis: efects of probiotic supplementation on lipid profles in normal to mildly hypercholesterolemic individuals. PLoS One 10,e0139795 (2015).
28.Lu, C. et al. Probiotic supplementation does not improve eradication rate of Helicobacter pylori infection compared to placebo based on standard therapy: a meta-analysis. Sci. Rep. 6, 23522 (2016).
29.Lü, M. et al. Efcacy of probiotic supplementation therapy for Helicobacter pylori eradication: a meta-analysis of randomized controlled trials.PLoS One 11, e0163743 (2016).
30.Kolber, M. R., Vandermeer, B. & Allan, G. M. Funding may infuence trial results examining probiotics and Clostridium difcile diarrhea rates.Am. J. Gastroenterol. 109, 1081–1082 (2014).
31.Allen, S. J., Martinez, E. G., Gregorio, G. V. & Dans, L. F. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst. Rev. 11,CD003048 (2010).
32.Feizizadeh, S., Salehi-Abargouei, A. & Akbari, V. Efcacy and safety of Saccharomyces boulardii for acute diarrhea. Pediatrics 134, e176–e191 (2014).
33.Szajewska, H., Skórka, A., Ruszczyński, M. & Gieruszczak-Białek, D.Meta-analysis: Lactobacillus GG for treating acute gastroenteritis in children—updated analysis of randomised controlled trials. Aliment.Pharmacol. Ter. 38, 467–476 (2013).
34.Van Niel, C. W., Feudtner, C., Garrison, M. M. & Christakis, D. A.Lactobacillus therapy for acute infectious diarrhea in children: a metaanalysis. Pediatrics 109, 678–684 (2002).
35.Goldenberg, J. Z. et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst. Rev. 11,CD004827 (2015).
36.Hempel, S. et al. Probiotics for the prevention and treatment of antibioticassociated diarrhea: a systematic review and meta-analysis. J. Am. Med.Assoc. 307, 1959–1969 (2012).
37.Jafarnejad, S. et al. Probiotics reduce the risk of antibiotic-associated diarrhea in adults (18–64 years) but not the elderly (>65 years): a meta-analysis. Nutr. Clin. Pract. 31, 502–513 2016).
38.Hickson, M. et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial. Br. Med. J. 335, 80 (2007).
39.Olek, A.et al. Efcacy and safety of Lactobacillus plantarum DSM 9843(LP299V) in the prevention of antibiotic-associated gastrointestinal symptoms in children-randomized, double-blind, placebo-controlled study.J. Pediatr. 186, 82–86 2017).
40.Allen, S. J. et al. Lactobacilli and bifdobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difcile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled,multicentre trial. Lancet 382, 1249–1257 (2013).
41.Freedman, S. B. et al. Multicenter trial of a combination probiotic for children with gastroenteritis. N. Engl. J. Med. 379, 2015–2026 2018).
42.Schnadower, D. et al. Lactobacillus rhamnosus GG versus placebo for acute gastroenteritis in children. N. Engl. J. Med. 379, 2002–2014 2018).
43.Freedman, S. B. et al. Gastroenteritis therapies in developed countries:systematic review and meta-analysis. PLoS One 10, e0128754 (2015).
44.Khanna, R., Lakhanpaul, M., Burman-Roy, S. & Murphy, M. S. Diarrhoea and vomiting caused by gastroenteritis in children under 5 years: summary of NICE guidance. Br. Med. J. 338, b1350 (2009).
45.Szajewska, H. et al. Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics. J. Pediatr. Gastroenterol. Nutr. 58, 531–539 (2014).
46.Li, S. T., Klein, E. J., Tarr, P. I. & Denno, D. M. Parental anagement of childhood diarrhea. Clin. Pediatr. (Phila.) 48, 295–303 (2009).
47.Goldenberg, J. Z. et al. Probiotics for the prevention of lostridium difcile–associated diarrhea in adults and children. Cochrane Database Syst.Rev. 5, CD006095 (2013).
48.Shen, N. T. et al. Timely use of probiotics in hospitalized adults prevents Clostridium difcile infection: a systematic review with eta-regression analysis. Gastroenterology 152, 1889–1900 e1889 (2017).
49.Goldenberg, J. Z. et al. Probiotics for the prevention of lostridium difcile–associated diarrhea in adults and children. Cochrane Database Syst.Rev. 12, CD006095 (2017).
50.McFarland, L. V. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difcile disease.Am. J. Gastroenterol. 101, 812–822 (2006).
51.Szajewska, H. & Kołodziej, M. Systematic review with meta-analysis:Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea.Aliment. Pharmacol. Ter. 42, 793–801 (2015).
52.Szajewska, H.et al. Probiotics for the prevention of antibiotic-associated diarrhea in children. J. Pediatr. Gastroenterol. Nutr. 62, 495–506 2016).
53.Georgieva, M. et al. Use of the probiotic Lactobacillus reuteri DSM 17938 in the prevention of antibiotic-associated infections in hospitalIzed Bulgarian children: a randomized, controlled trial. J. IMAB–Annu. Proc. Sci. Pap. 21,895–900 (2015).
54.Ouwehand, A. C. et al. Probiotics reduce symptoms of antibiotic use in a hospital setting: a randomized dose response study. Vaccine 32,458–463 (2014).
55.Klarin, B. et al. Lactobacillus plantarum 299v reduces colonisation of Clostridium difcile in critically ill patients treated with antibiotics.
Acta Anaesthesiol. Scand. 52, 1096–1102 (2008).
56.Morrow, L. E., Kollef, M. H. & Casale, T. B. Probiotic prophylaxis of
ventilator-associated pneumonia: a blinded, randomized, controlled trial.Am. J. Respir. Crit. Care Med. 182, 1058–1064 (2010).
57.Shan, L. S. et al. Prevention and treatment of diarrhoea with Saccharomyces boulardii in children with acute lower respiratory tract infections.Benef. Microbes 4, 329–334 (2013).
58.Rafq, R. et al. in Gastroenterology, Vol. 132. A187 (WB Saunders Co–Elsevier, 2007).
59.Lemann, M., Cezard, J., Ruemmele, F. & Turck, D. European Society for Paediatric Gastroenterology, Hepatology, and Nutrition Annual Meeting June 3–6, 2009 Budapest, Hungary. J. Pediatr. Gastroenterol. Nutr. 48,E1–E149 (2009).
60.Viggars, A. P., Gracie, D. J. & Ford, A. C. Use of probiotics in hospitalized adults to prevent Clostridium difcile infection: owngrade the quality of evidence?. Gastroenterology 153, 1451–1452 (2017).
61.McFarland, L. V. Deciphering meta-analytic results: a mini-review of probiotics for the prevention of paediatric antibiotic-associated diarrhoea and Clostridium difcile infections. Benef. Microbes 6, 189–194 (2015).
62.Guyonnet, D. et al. Efect of a fermented milk containing Bifdobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care: a multicentre,randomized, double-blind, controlled trial. Aliment. Pharmacol. Ter. 26,475–486 (2007).
63.Ford, A. C., Harris, L. A., Lacy, B. E., Quigley, E. M. M. & Moayyedi, P.Systematic review with meta-analysis: the efcacy of prebiotics, probiotics,synbiotics and antibiotics in irritable bowel syndrome. Aliment. Pharmacol.Ter. 48, 1044–1060 (2018).
64.McKenzie, Y. A., Tompson, J., Gulia, P. & Lomer, M. C. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J. Hum. Nutr. Diet. 29,576–592 (2016).
65.Olsen, R., Greisen, G., Schrøder, M. & Brok, J. Prophylactic probiotics for preterm infants: a systematic review and meta-analysis of observational studies. Neonatology 109, 105–112 (2016).
66.Rao, S. C., Athalye-Jape, G. K., Deshpande, G. C., Simmer, K. N. & Patole, S. K. Probiotic supplementation and late-onset sepsis in preterm infants: a meta-analysis. Pediatrics 137, e20153684 (2016).
67.Ganguli, K. et al. Probiotics prevent necrotizing enterocolitis by modulating enterocyte genes that regulate innate immune-mediated infammation.Am. J. Physiol. Gastrointest. Liver Physiol. 304, G132–G141 (2013).
68.Yan, F. et al. Neonatal colonization of mice with LGG promotes intestinal development and decreases susceptibility to colitis in adulthood. Mucosal Immunol. 10, 117–127 (2017).
69.Costeloe, K., Hardy, P., Juszczak, E., Wilks, M. & Millar, M. R.Bifdobacterium breve BBG-001 in very preterm infants: a andomised controlled phase 3 trial. Lancet 387, 649–660 (2016).
70.AlFaleh, K. & Anabrees, J. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst. Rev.4,CD005496 (2014).
71.Aceti, A. et al. Probiotics prevent late-onset sepsis in human milk-fed, very low birth weight preterm infants: systematic review and meta-analysis.Nutrients 9, 904 (2017).
72.Dermyshi, E. et al. Te “golden age” of probiotics: a systematic review and meta-analysis of randomized and observational studies in preterm infants.Neonatology 112, 9–23 (2017).
73.Zhang, G. Q., Hu, H. J., Liu, C. Y., Shakya, S. & Li, Z. Y. Probiotics for preventing late-onset sepsis in preterm neonates: A PRISMA-compliant systematic review and meta-analysis of randomized controlled trials.Med. (Baltim.) 95, e2581 (2016).
74.Sommer, F. & Bäckhed, F. Te gut microbiota—masters of host development and physiology. Nat. Rev. Microbiol. 11, 227–238 (2013).
75.King, S. et al. Does probiotic consumption reduce antibiotic utilization for common acute infections? A systematic review and meta-analysis.Eur. J. Public Health
76.Hao, Q., Dong, B.R. & Wu, T. Probiotics for preventing acute upper respiratory tract infections. Cochrane Database Syst. Rev. 2,CD006895 (2015).
77.Vouloumanou, E. K., Makris, G. C., Karageorgopoulos, D. E. &Falagas, M. E. Probiotics for the prevention of respiratory tract infections: a systematic review. Int. J. Antimicrob. Agents 34, 197.e1–197.e10 (2009).
78.Merenstein, D. et al. Use of a fermented dairy probiotic drink containing Lactobacillus casei (DN-114 001) to decrease the rate of illness in kids: the DRINK study. A patient-oriented, double-blind, cluster-randomized,placebo-controlled, clinical trial. Eur. J. Clin. Nutr. 64, 669–677 (2010).
79.de Vrese, M. et al. Efect of Lactobacillus gasseri PA 16/8, Bifdobacterium longum SP 07/3, B. bifdum MF 20/5 on common cold episodes: a double blind, randomized, controlled trial. Clin. Nutr. (Edinb., Scotl.) 24,481–491 (2005).
80.Smith, T. J., Rigassio-Radler, D., Denmark, R., Haley, T. & Touger-Decker,R. Efect of Lactobacillus rhamnosus LGG® and Bifdobacterium animalis ssp.lactis BB-12® on health-related quality of life in college students afected by upper respiratory infections. Br. J. Nutr. 109, 1999–2007 (2013).
81.Shinkai, S. et al. Immunoprotective efects of oral intake of heat-killed Lactobacillus pentosus strain b240 in elderly adults: a randomised,double-blind, placebo-controlled trial. Br. J. Nutr. 109, 1856–1865 (2013).
82.Hatakka, K. et al. Efect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial. Br. Med. J. 322, 1327 (2001).
83.West, N. P. et al. Lactobacillus fermentum (PCC®) supplementation and gastrointestinal and respiratory-tract illness symptoms: a randomised control trial in athletes. Nutr. J. 10, 30 (2011).
84.Murata, M. et al. Efects of paraprobiotic Lactobacillus paracasei MCC1849 supplementation on symptoms of the common cold and mood states in healthy adults. Benef. Microbes 9, 855–864 (2018).
85.Atarashi, K. et al. TH17 cell induction by adhesion of microbes to intestinal epithelial cells. Cell 163, 367–380 (2015).
86.Taiss, C. A. et al. Microbiota diurnal rhythmicity programs host transcriptome oscillations. Cell 167, 1495–1510.e12 (2016).
87.Uchimura, Y. et al. Antibodies set boundaries limiting microbial metabolite penetration and the resultant mammalian host response. Immunity 49,545–559.e5 (2018).
88.Mattar, A. F. et al. Probiotics up-regulate MUC-2 mucin gene expression in a Caco-2 cell-culture model. Pediatr. Surg. Int. 18, 586–590 (2002).
89.Zmora, N. et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features.Cell 174, 1388–1405.e21 (2018).
90.Turroni, F. et al. Role of sortase-dependent pili of Bifdobacterium bifdum PRL2010 in modulating bacterium-host interactions. Proc. Natl Acad. Sci.USA 110, 11151–11156 (2013).
91.Van Tassell, M. L. & Miller, M. J. Lactobacillus adhesion to mucus. Nutrients 3, 613–636 (2011).
92.Fujimura, S. et al. Detection of Lactobacillus gasseri OLL2716 strain administered with yogurt drink in gastric mucus layer in humans.Lett. Appl. Microbiol. 43, 578–581 (2006).
93.Valeur, N., Engel, P., Carbajal, N., Connolly, E. & Ladefoged, K.Colonization and immunomodulation by Lactobacillus reuteri ATCC 55730 in the human gastrointestinal tract. Appl. Environ. Microbiol. 70,1176–1181 (2004).
94.Johansson, M. L. et al. Administration of diferent Lactobacillus strains in fermented oatmeal soup: in vivo colonization of human intestinal mucosa and efect on the indigenous fora. Appl. Environ. Microbiol. 59,15–20 (1993).
95.Shibahara-Sone, H. et al. Living cells of probiotic Bifdobacterium bifdum YIT 10347 detected on gastric mucosa in humans. Benef. Microbes 7,319–326 (2016).
96.Yang, Y., Galle, S., Le, M. H., Zijlstra, R. T. & Gänzle, M. G. Feed fermentation with reuteran- and levan-producing Lactobacillus reuteri reduces colonization of weanling pigs by enterotoxigenic Escherichia coli.Appl. Environ. Microbiol. 81, 5743–5752 (2015).
97.Riboulet-Bisson, E. et al. Efect of Lactobacillus salivarius bacteriocin Abp118 on the mouse and pig intestinal microbiota. PLoS One 7,e31113 (2012).
98.Crittenden, R. et al. Lactobacillus paracasei subsp. paracasei F19:Survival, ecology and safety in the human intestinal tract-A survey of feeding studies within the PROBDEMO project. Microb. Ecol. Health Dis.14, 22–26 (2002).
99.Goossens, D. A., Jonkers, D. M., Russel, M. G., Stobberingh, E. E. &Stockbrügger, R. W. Te efect of a probiotic drink with Lactobacillus plantarum 299v on the bacterial composition in faeces and mucosal biopsies of rectum and ascending colon. Aliment. Pharmacol. Ter. 23,255–263 (2006).
100.Alander, M. et al. Persistence of colonization of human colonic mucosa by a probiotic strain, Lactobacillus rhamnosus GG, afer oral consumption.Appl. Environ. Microbiol. 65, 351–354 (1999).
101.Gianotti, L. et al. A randomized double-blind trial on erioperative administration of probiotics in colorectal cancer patients. World J.Gastroenterol. 16, 167–175 (2010).
102.Suez, J., Zmora, N. & Elinav, E. Probiotics in the next-generation sequencing era. Gut Microbes 5, 1–17 (2019).
103.Zhang, C. et al. Ecological robustness of the gut microbiota in response to ingestion of transient food-borne microbes. ISME J. 10, 2235–2245 (2016).
104.Charbonneau, D., Gibb, R. D. & Quigley, E. M. Fecal excretion of Bifdobacterium infantis 35624 and changes in fecal microbiota afer eight weeks of oral supplementation with encapsulated probiotic. Gut Microbes 4,201–211 (2013).
105.Alander, M. et al. Efect of galacto-oligosaccharide supplementation on human faecal microfora and on survival and persistence of Bifdobacterium lactis Bb-12 in the gastrointestinal tract. Int. Dairy J. 11, 817–825 (2001).
106.Firmesse, O., Mogenet, A., Bresson, J. L., Corthier, G. & Furet, J. P.Lactobacillus rhamnosus R11 consumed in a food supplement survived human digestive transit without modifying microbiota equilibrium as assessed by real-time polymerase chain reaction. J. Mol. Microbiol.Biotechnol. 14, 90–99 (2008).
107.Rochet, V. et al. Efects of orally administered Lactobacillus casei DN-114 001 on the composition or activities of the dominant faecal microbiota in healthy humans. Br. J. Nutr. 95, 421–429 (2006).
108.Garrido, D., Suau, A., Pochart, P., Cruchet, S. & Gotteland, M.Modulation of the fecal microbiota by the intake of a Lactobacillus johnsonii La1-containing product in human volunteers. FEMS Microbiol. Lett. 248,249–256 (2005).
109.Goossens, D. et al. Te efect of Lactobacillus plantarum 299v on the bacterial composition and metabolic activity in faeces of healthy volunteers: a placebo-controlled study on the onset and duration of efects.Aliment. Pharmacol. Ter. 18, 495–505 (2003).
110.Smith, T. J., Anderson, D., Margolis, L. M., Sikes, A. & Young, A. J.Persistence of Lactobacillus reuteri DSM17938 in the human ntestinal tract:response to consecutive and alternate-day supplementation. J. Am. Coll.Nutr. 30, 259–264 (2011).
111.Jacobsen, C. N. et al. Screening of probiotic activities of forty-seven strains of Lactobacillus spp. by in vitro techniques and evaluation of the colonization ability of fve selected strains in humans. Appl. Environ.Microbiol. 65, 4949–4956 (1999).
112.Sierra, S. et al. Intestinal and immunological efects of daily oral administration of Lactobacillus salivarius CECT5713 to healthy adults.Anaerobe 16, 195–200 (2010).
113.Frese, S. A., Hutkins, R. W. & Walter, J. Comparison of the colonization ability of autochthonous and allochthonous strains of lactobacilli in the human gastrointestinal tract. Adv. Microbiol. 2, 399 (2012).
114.Tannock, G. W. et al. Analysis of the fecal microfora of human subjects consuming a probiotic product containing Lactobacillus rhamnosus DR20.Appl. Environ. Microbiol. 66, 2578–2588 (2000).
115.Maldonado-Gómez, M. X. et al. Stable engrafment of Bifdobacterium longum AH1206 in the human gut depends on individualized features of the resident microbiome. Cell Host Microbe 20, 515–526 (2016).
116.Suez, J. et al. Post-antibiotic gut mucosal microbiome reconstitution is impaired by probiotics and improved by autologous FMT. Cell 174,1406–1423.e16 (2018).
117.Chung, H. et al. Gut immune maturation depends on colonization with a host-specifc microbiota. Cell 149, 1578–1593 (2012).
118.Dogi, C. A. & Perdigón, G. Importance of the host specifcity in the selection of probiotic bacteria. J. Dairy Res. 73, 357–366 (2006).
119.Marcobal, A. et al. A metabolomic view of how the human gut microbiota impacts the host metabolome using humanized and gnotobiotic mice.ISME J. 7, 1933–1943 (2013).
120.de Vrese, M. et al. Probiotics—compensation for lactase insufciency.Am. J. Clin. Nutr. 73, 421S–429S (2001).
121.Bonder, M. J. et al. Te efect of host genetics on the gut microbiome.Nat. Genet. 48, 1407–1412 (2016).
122.Macho Fernandez, E. et al. Anti-infammatory capacity of selected lactobacilli in experimental colitis is driven by NOD2-mediated recognition of a specifc peptidoglycan-derived muropeptide. Gut 60, 1050–1059 (2011).
123.Lin, Y. P., Tibodeaux, C. H., Peña, J. A., Ferry, G. D. & Versalovic, J.Probiotic Lactobacillus reuteri suppress proinfammatory cytokines viac-Jun. Infamm. Bowel Dis. 14, 1068–1083 (2008).
124.Lavasani, S. et al. A novel probiotic mixture exerts a therapeutic efect on experimental autoimmune encephalomyelitis mediated by IL-10 producing regulatory T cells. PLoS One 5, e9009 (2010).
125.Tomas, C. M. & Versalovic, J. Probiotics–host communication:modulation of signaling pathways in the intestine. Gut Microbes 1,148–163 (2010).
126.van Baarlen, P. et al. Diferential NF-κB pathways induction by Lactobacillus plantarum in the duodenum of healthy humans correlating with immune tolerance. Proc. Natl Acad. Sci. USA 106, 2371–2376 (2009).
127.Matsuguchi, T. et al. Lipoteichoic acids from Lactobacillus strains elicit strong tumor necrosis factor alpha-inducing activities in macrophages through Toll-like receptor 2. Clin. Diagn. Lab. Immunol. 10,259–266 (2003).
128.Medina, M., Izquierdo, E., Ennahar, S. & Sanz, Y. Diferential immunomodulatory properties of Bifdobacterium logum strains: relevance to probiotic selection and clinical applications. Clin. Exp. Immunol. 150,531–538 (2007).
129.Schiavi, E. et al. Te surface-associated exopolysaccharide of Bifdobacterium longum 35624 plays an essential role in dampening host proinfammatory responses and repressing local T17 responses.Appl. Environ. Microbiol. 82, 7185–7196 (2016).
130.von Ossowski, I. et al. Using recombinant Lactococci as an approach to dissect the immunomodulating capacity of surface piliation in probiotic Lactobacillus rhamnosus GG. PLoS One 8, e64416 (2013).
131.Ardita, C. S. et al. Epithelial adhesion mediated by pilin SpaC is required for Lactobacillus rhamnosus GG–induced cellular responses. Appl. Environ.Microbiol. 80, 5068–5077 (2014).
132.Yanagihara, S. et al. Uromodulin-SlpA binding dictates Lactobacillus acidophilus uptake by intestinal epithelial M cells. Int. Immunol. 29,357–363 (2017).
133.Konieczna, P. et al. Bifdobacterium infantis 35624 administration induces Foxp3 T regulatory cells in human peripheral blood:potential role for myeloid and plasmacytoid dendritic cells. Gut 61,354–366 (2012).
134.Fukushima, Y., Kawata, Y., Hara, H., Terada, A. & Mitsuoka, T. Efect of a probiotic formula on intestinal immunoglobulin A production in healthy children. Int. J. Food Microbiol. 42, 39–44 (1998).
135.Galdeano, C. M. & Perdigón, G. Te probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Clin. Vaccin. Immunol. 13, 219–226 (2006).
136.Gueimonde, M., Margolles, A., de los Reyes-Gavilán, C. G. & Salminen, S.Competitive exclusion of enteropathogens from human intestinal mucus by Bifdobacterium strains with acquired resistance to bile—a preliminary study. Int. J. Food Microbiol. 113, 228–232 (2007).
137.Tsai, C. C. et al. Antagonistic activity against Salmonella infection in vitro and in vivo for two Lactobacillus strains from swine and poultry.Int. J. Food Microbiol. 102, 185–194 (2005).
138.Kim, Y., Kim, S. H., Whang, K. Y., Kim, Y. J. & Oh, S. Inhibition of Escherichia coli O157:H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells. J. Microbiol. Biotechnol. 18,1278–1285 (2008).
139.Fukuda, S. et al. Bifdobacteria can protect from enteropathogenic infection through production of acetate. Nature 469, 543–547 (2011).140.Cotter, P. D., Hill, C. & Ross, R. P. Bacteriocins: developing innate immunity for food. Nat. Rev. Microbiol. 3, 777–788 (2005).
141.Corr, S. C. et al. Bacteriocin production as a mechanism for the antiinfective activity of Lactobacillus salivarius UCC118. Proc. Natl Acad.Sci. USA 104, 7617–7621 (2007).
142.Medellin-Peña, M. J., Wang, H., Johnson, R., Anand, S. & Grifths, M. W.Probiotics afect virulence-related gene expression in Escherichia coliO157:H7. Appl. Environ. Microbiol. 73, 4259–4267 (2007).
143.Yun, B., Oh, S. & Grifths, M. W. Lactobacillus acidophilus modulates the virulence of Clostridium difcile. J. Dairy Sci. 97, 4745–4758 (2014).
144.Li, J., Wang, W., Xu, S. X., Magarvey, N. A. & McCormick, J. K.Lactobacillus reuteri-produced cyclic dipeptides quench agr-mediated expression of toxic shock syndrome toxin-1 in staphylococci. Proc. NatlAcad. Sci. USA 108, 3360–3365 (2011).
145.Miller, M. B. & Bassler, B. L. Quorum sensing in bacteria. Annu. Rev.Microbiol. 55, 165–199 (2001).
146.Lagrafeuille, R. et al. Opposing efect of Lactobacillus on in vitro Klebsiella pneumoniae in bioflm and in an in vivo intestinal colonisation model.Benef. Microbes 9, 87–100 (2018).
147.Tompson, J. A., Oliveira, R. A., Djukovic, A., Ubeda, C. & Xavier, K. B.Manipulation of the quorum sensing signal AI-2 afects the antibiotictreated gut microbiota. Cell Rep. 10, 1861–1871 (2015).
148.Ohland, C. L. & Macnaughton, W. K. Probiotic bacteria and intestinal epithelial barrier function. Am. J. Physiol. Gastrointest. Liver Physiol. 298,G807–G819 (2010).
149.Miyamoto, J. et al. A gut microbial metabolite of linoleic acid, 10-hydroxycis-12-octadecenoic acid, ameliorates intestinal epithelial barrier impairment partially via GPR40–MEK–ERK pathway. J. Biol. Chem. 290,2902–2918 (2015).
150.Kaikiri, H. et al. Supplemental feeding of a gut microbial metabolite of linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, alleviates spontaneous atopic dermatitis and modulates intestinal microbiota in NC/nga mice.Int. J. Food Sci. Nutr. 68, 941–951 (2017).
151.Yamada, M. et al. A bacterial metabolite ameliorates periodontal pathogen-induced gingival epithelial barrier disruption via GPR40 signaling. Sci. Rep. 8, 9008 (2018).
152.Yan, F. et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. astroenterology 132, 562–575 (2007).
153.Mack, D. R., Ahrne, S., Hyde, L., Wei, S. & Hollingsworth, M. A.Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut 52, 827–833 (2003).
154.Gaudier, E., Michel, C., Segain, J. P., Cherbut, C. & Hoebler, C. Te VSL# 3 probiotic mixture modifes microfora but does not heal chronic dextransodium sulfate-induced colitis or reinforce the mucus barrier in mice.J. Nutr. 135, 2753–2761 (2005).
155.Caballero-Franco, C., Keller, K., De Simone, C. & Chadee, K. Te VSL#3 probiotic formula induces mucin gene expression and secretion in colonic epithelial cells. Am. J. Physiol. Gastrointest. Liver Physiol. 292,G315–G322 (2007).
156.Persborn, M. et al. Te efects of probiotics on barrier function and mucosal pouch microbiota during maintenance treatment for severe pouchitis in patients with ulcerative colitis. Aliment. harmacol. Ter. 38,772–783 (2013).
157.Jones, C. et al. Modulation of gut barrier function in patients with obstructive jaundice using probiotic LP299v. Eur. J. Gastroenterol. Hepatol.25, 1424–1430 (2013).
158.Zeng, J. et al. Clinical trial: efect of active lactic acid bacteria on mucosal barrier function in patients with diarrhoea-predominant irritable bowel syndrome. Aliment. Pharmacol. Ter. 28, 994–1002 (2008).
159.Sabico, S. et al. Efects of a multi-strain probiotic supplement for 12 weeks in circulating endotoxin levels and cardiometabolic profles of medication naïve T2DM patients: a randomized clinical trial. J. Transl. Med.15, 249 (2017).
160.Wilms, E. et al. Efects of supplementation of the synbiotic ecologic®825/FOS P6 on intestinal barrier function in healthy humans: a randomized controlled trial. PLoS One 11, e0167775 (2016).
161.Horvath, A. et al. Randomised clinical trial: the efects of a multispecies probiotic vs. placebo on innate immune function, bacterial translocation and gut permeability in patients with cirrhosis. Aliment. Pharmacol. Ter.44, 926–935 (2016).
162.Stadlbauer, V. et al. Lactobacillus casei shirota supplementation does not restore gut microbiota composition and gut barrier in metabolic syndrome:a randomized pilot study. PLoS One 10, e0141399 (2015).
163.Joyce, S. A. et al. Regulation of host weight gain and lipid metabolism by bacterial bile acid modifcation in the gut. Proc. Natl Acad. Sci. USA 111,7421–7426 (2014).
164.Costabile, A. et al. An in vivo assessment of the cholesterol-lowering efcacy of Lactobacillus plantarum ECGC 13110402 in normal to mildly hypercholesterolaemic adults. PLoS One 12, e0187964 (2017).
165.Sun, L. et al. Gut microbiota and intestinal FXR mediate the clinical benefts of metformin. Nat. Med. 24, 1919–1929 (2018).
166.Sarkar, A. et al. Psychobiotics and the manipulation of bacteria–gut–brain signals. Trends Neurosci. 39, 763–781 (2016).
167.Bravo, J. A. et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc. Natl Acad. Sci. USA 108, 16050–16055 (2011).
168.Kelly, J. R. et al. Lost in translation? Te potential psychobiotic Lactobacillus rhamnosus (JB-1) fails to modulate stress or cognitive performance in healthy male subjects. Brain Behav. Immun. 61, 50–59 (2017).
169.Bufngton, S. A. et al. Microbial reconstitution reverses maternal diet-induced social and synaptic defcits in ofspring. Cell 165,1762–1775 (2016).
170.Perez-Burgos, A. et al. Te TRPV1 channel in rodents is a major target for antinociceptive efect of the probiotic Lactobacillus reuteri DSM 17938.J. Physiol. (Lond.) 593, 3943–3957 (2015).
171.Rousseaux, C. et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat. Med. 13,35–37 (2007).
172.Reis, D. J., Ilardi, S. S. & Punt, S. E. W. Te anxiolytic efect of probiotics: a systematic review and meta-analysis of the clinical and preclinical literature.PLoS One 13, e0199041 (2018).
173.Kristensen, N. B. et al. Alterations in fecal microbiota composition by probiotic supplementation in healthy adults: a systematic review of randomized controlled trials. Genome Med. 8, 52 (2016).
174.McFarland, L. V. Use of probiotics to correct dysbiosis of normal microbiota following disease or disruptive events: a systematic review.BMJ Open 4, e005047 (2014).
175.Jakobsson, H. E. et al. Short-term antibiotic treatment has difering long-term impacts on the human throat and gut microbiome. PLoS One 5,e9836 (2010).
176.Sommer, F., Anderson, J. M., Bharti, R., Raes, J. & Rosenstiel, P. Te resilience of the intestinal microbiota infuences health and disease.Nat. Rev. Microbiol. 15, 630–638 (2017).
177.Bruzzese, E. et al. Disrupted intestinal microbiota and intestinal infammation in children with cystic fbrosis and its restoration with Lactobacillus GG: a randomised clinical trial. PLoS One 9, e87796 (2014).
178.Zoppi, G., Cinquetti, M., Benini, A., Bonamini, E. & Minelli, E. B.Modulation of the intestinal ecosystem by probiotics and lactulose in children during treatment with cefriaxone. Curr. Ter. Res. Clin. Exp. 62,418–435 (2001).
179.Wang, Z. J. et al. Efects of anti–Helicobacter pylori concomitant therapy and probiotic supplementation on the throat and gut microbiota in humans.Microb. Pathog. 109, 156–161 (2017).
180.Khalesi, S. et al. A review of probiotic supplementation in healthy adults:helpful or hype?. Eur. J. Clin. Nutr. 73, 24–37, doi: (2019).
181.Ricci, A. et al. Update of the list of QPS‐recommended biological agents intentionally added to food or feed as notifed to EFSA 8: suitability of taxonomic units notifed to EFSA until March 2018. EFSA Journal 16,e05315 (2018).
182.Quin, C. et al. Probiotic supplementation and associated infant gut microbiome and health: a cautionary retrospective clinical comparison.Sci. Rep. 8, 8283 (2018).
183.Topcuoglu, S., Gursoy, T., Ovali, F., Serce, O. & Karatekin, G. A new risk factor for neonatal vancomycin-resistant Enterococcus colonisation:bacterial probiotics. J. Matern. Fetal Neonatal Med. 28, 1491–1494 (2015).
184.Didari, T., Solki, S., Mozafari, S., Nikfar, S. & Abdollahi, M.A systematic review of the safety of probiotics. Expert Opin. Drug Saf.13, 227–239 (2014).
185.Carvour, M. L. et al. Predictors of Clostridium difcile infection and predictive impact of probiotic use in a diverse hospital-wide cohort.Am. J. Infect. Control 47, 2–8, doi: (2019).
186.Besselink, M. G. et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet371, 651–659 (2008).
187.Hempel, S. et al. Safety of probiotics used to reduce risk and prevent or treat disease. Evid. Rep. Technol. Assess. (Full Rep.) 1–645 (2011).
188.Bafeta, A., Koh, M., Riveros, C. & Ravaud, P. Harms reporting in randomized controlled trials of interventions aimed at modifying microbiota: a systematic review. Ann. Intern. Med. 169, 240–247 (2018). .
189.US Food & Drug Administration. Development & approval process (drugs). https://www.fda.gov/drugs/developmentapprovalprocess/default.
htm (2018).
190.Grazul, H., Kanda, L. L. & Gondek, D. Impact of probiotic supplements on microbiome diversity following antibiotic treatment of mice. Gut Microbes 7, 101–114 (2016).
191.Kabbani, T. A. et al. Prospective randomized controlled study on the efects of Saccharomyces boulardii CNCM I-745 and amoxicillin-clavulanate or the combination on the gut microbiota of healthy volunteers. Gut Microbes 8,17–32 (2017).
192.De Wolfe, T. J. et al. Oral probiotic combination of Lactobacillus and Bifdobacterium alters the gastrointestinal microbiota during antibiotic treatment for Clostridium difcile infection. PLoS One 13, e0204253 (2018).
193.Brecht, M., Garg, A., Longstaf, K., Cooper, C. & Andersen, C. Lactobacillus sepsis following a laparotomy in a preterm infant: a note of caution.Neonatology 109, 186–189 (2016).
194.Spinler, J. K. et al. Administration of probiotic kefr to mice with Clostridium difcile infection exacerbates disease. Anaerobe 40,54–57 (2016).
195.Oliveira, B. C. M. & Widmer, G. Probiotic product enhances susceptibility of mice to cryptosporidiosis. Appl. Environ. Microbiol. 84,e01408–18 (2018).
196.He, F. et al. Diferences in composition and mucosal adhesion of Bifdobacteria isolated from healthy adults and healthy seniors.Curr. Microbiol. 43, 351–354 (2001).
197.Kankaanpää, P. E., Salminen, S. J., Isolauri, E. & Lee, Y. K. Te infuence of polyunsaturated fatty acids on probiotic growth and adhesion. FEMS Microbiol. Lett. 194, 149–153 (2001).
198.Shepherd, E. S., DeLoache, W. C., Pruss, K. M., Whitaker, W. R. &Sonnenburg, J. L. An exclusive metabolic niche enables strain engrafment in the gut microbiota. Nature 557, 434–438 (2018).
199.Andriantsoanirina, V., Teolis, A. C., Xin, L. X., Butel, M. J. & Aires, J.Bifdobacterium longum and Bifdobacterium breve isolates from preterm and full term neonates: comparison of cell surface properties. Anaerobe 28,212–215 (2014).
200.Roessler, A. et al. Te immune system in healthy adults and patients with atopic dermatitis seems to be afected diferently by a probiotic intervention. Clin. Exp. Allergy 38, 93–102 (2008).
201.Pelto, L., Isolauri, E., Lilius, E. M., Nuutila, J. & Salminen, S. Probiotic bacteria down-regulate the milk-induced infammatory response in milk-hypersensitive subjects but have an immunostimulatory efect in healthy subjects. Clin. Exp. Allergy 28, 1474–1479 (1998).
202.Hod, K. et al. Te efect of a multispecies probiotic on microbiota composition in a clinical trial of patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol. Motil. 30, e13456 (2018).
203.Suwal, S. et al. Te probiotic efectiveness in preventing experimental colitis is correlated with host gut microbiota. Front. Microbiol. 9,2675 (2018).
204.Abildgaard, A., et al. Te antidepressant-like efect of probiotics and their faecal abundance may be modulated by the cohabiting gut microbiota in rats. Eur. Neuropsychopharmacol. 29, 98–110 (2019).
205.Ferrario, C. et al. Modulation of fecal Clostridiales bacteria and butyrate by probiotic intervention with Lactobacillus paracasei DG varies among healthy adults. J. Nutr. 144, 1787–1796 (2014).
206.Knight, R. et al. Best practices for analysing microbiomes. Nat. Rev.Microbiol. 16, 410–422 (2018).
207.Degirolamo, C., Rainaldi, S., Bovenga, F., Murzilli, S. & Moschetta, A.Microbiota modifcation with probiotics induces hepatic bile acid synthesis via downregulation of the Fxr–Fgf15 axis in mice. Cell Rep. 7,12–18 (2014).
208.García-Albiach, R. et al. Molecular analysis of yogurt containing Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus in human intestinal microbiota. Am. J. Clin. Nutr. 87, 91–96 (2008).
209.Ouwehand, A. C. et al. Bifdobacterium microbiota and parameters of immune function in elderly subjects. FEMS Immunol. Med. Microbiol. 53,18–25 (2008).
210.Korpela, K. et al. Probiotic supplementation restores normal microbiota composition and function in antibiotic-treated and in caesarean-born infants. Microbiome 6, 182 (2018).
211.Wang, C. et al. Intestinal microbiota profles of healthy pre-school and school-age children and efects of probiotic supplementation. Ann. Nutr.Metab. 67, 257–266 (2015).
212.Mohan, R. et al. Efects of Bifdobacterium lactis Bb12 supplementation on intestinal microbiota of preterm infants: a double-blind, placebo-controlled,randomized study. J. Clin. Microbiol. 44, 4025–4031 (2006).
213.Veiga, P. et al. Changes of the human gut microbiome induced by a fermented milk product. Sci. Rep. 4, 6328 (2014).
214.Brahe, L. K. et al. Dietary modulation of the gut microbiota—a randomised controlled trial in obese postmenopausal women. Br. J. Nutr. 114,406–417 (2015).
215.McNulty, N. P. et al. Te impact of a consortium of fermented milk strains on the gut microbiome of gnotobiotic mice and monozygotic twins. Sci.Transl. Med. 3, 106ra106 (2011).
216.Eloe-Fadrosh, E. A. et al. Functional dynamics of the gut microbiome in elderly people during probiotic consumption. mBio 6, e00231-15 (2015).
217.Martin, F. P. et al. Probiotic modulation of symbiotic gut microbial–host metabolic interactions in a humanized microbiome mouse model. Mol. Syst.Biol. 4, 157 (2008).
218.Burton, K. J. et al. Probiotic yogurt and acidifed milk similarly reduce postprandial infammation and both alter the gut microbiota of healthy,young men. Br. J. Nutr. 117, 1312–1322 (2017).
219.Kajander, K. et al. Efects of multispecies probiotic supplementation on intestinal microbiota in irritable bowel syndrome. Aliment. Pharmacol. Ter.26, 463–473 (2007).
220.Donaldson, G. P., Lee, S. M. & Mazmanian, S. K. Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 14, 20–32 (2016).
221. Uronis, J. M. et al. Gut microbial diversity is reduced by the probiotic VSL#3 and correlates with decreased TNBS-induced colitis. Infamm. Bowel Dis. 17, 289–297 (2011).
222.Arthur, J. C. et al. VSL#3 probiotic modifes mucosal microbial composition but does not reduce colitis-associated colorectal cancer. Sci. Rep. 3,2868 (2013).
223.Kühbacher, T. et al. Bacterial and fungal microbiota in relation to probiotic therapy (VSL#3) in pouchitis. Gut 55, 833–841 (2006).
原文链接:https://www.nature.com/articles/s41591-019-0439-x
作者|Jotham Suez, Niv Zmora, Eran Segal , Eran Elinav
编译|ninety
审校|617
编辑|笑咲


