
编者按:
随着现有药物耐药性问题日趋严重,抗生素管道频临枯竭。然而在目前处于临床试验阶段的 50 种抗生素中,有 32 种针对世卫组织所列的优先病原体,但与现有抗生素相比,这些研发中的新药大多数效用有限。因此,抗生素的研发工作迫在眉睫。
但是,由于抗生素研发成本高昂,利润有限,因此许多大型制药公司都放弃了抗生素的研发项目。那么,应该如何挽救逐渐崩溃的抗生素研发?
今天,我们共同关注抗生素的研发,特别编译发表在 Nature Outlook 上的文章,希望本文能够为相关的产业人士和读者带来一些启发和帮助。
世界各地的科学家、公共卫生机构和政府都在警告说,抗生素耐药性将会是下一个全球重大健康危机。因为自 20 世纪 60 年代以来,细菌和其他某些微生物对抗生素的耐药性越来越强,并且已经导致了越来越多的人死亡。
现如今,每年都会有约 70 万人因为耐药性而死亡。联合国抗生素耐药性研究小组估计,若仍不采取改变措施,到 2050 年,这一数字可能会迅速增长至 1000 万,超过全球范围内每年死于癌症的人数。
显然,我们对新抗菌药物的需求越来越大,但是相关的药物并没有出现,每年上市的抗生素药物越来越少,最后一类全新的抗生素药物还是在 20 世纪 80 年代末被研发出来的。出现这种情况的原因之一是将抗生素推向市场对制药公司而言往往无利可图。
据估计,2017 年开发一种抗生素的成本约为 15 亿美元1,然而,相较于如此高的成本,抗生素药物每年却只能给制药公司带来 4600 万美元的收入。Novo Holdings(一家专注于生物产业的投资公司,位于丹麦赫尔勒鲁普)的首席执行官 Kasim Kutay 表示:“抗生素药物投资所带来的收益过小,以至于难以证明这项投资是合理的。”
由于研发抗生素药物所带来的利润过少,导致许多大型制药公司退出了该市场,并转向能够带来更多利润的药物开发,例如癌症治疗药物。取而代之的是一些规模较小的制药公司和融资机构。因此,我们可能需要一种较为激进的方法,来解决药物开发成本过高而收益较低这一经济问题。
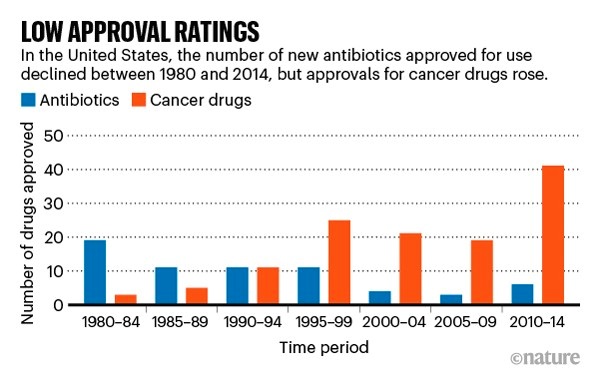
根据英国生物医学基金慈善机构 Wellcome 统计,自上世纪 40 年代开始大规模引入抗生素以来,传染病所引起的死亡人数已经下降了 70%。然而就目前的情况来看,除非我们重塑抗生素的市场经济,否则世界健康可能会重新处于危险的境地。
2017 年的一项研究发现,在 2011 年到 2015 年间,亚太地区的一种细菌对左氧氟沙星(一种用于治疗多种细菌感染疾病的抗生素)的耐药率,已经从 2000 年的 2%左右上升至 27%2。
针对这种情况,印度北部的阿里加穆斯林大学的微生物学家 Asad Khan 警告道:“这一问题十分严峻,在不久的将来就会发生。可是我认为很多政府和资助机构至今还是没有意识到我们所面临的困难有多可怕。”
经济学研究在解决抗生素的上市困难问题中起到重要作用。可很多经济学家还是迟迟没有采取行动。一项研究发现,EconLit 数据库的 100 多万篇经济学文章中,只有 55 篇与细菌对抗生素的耐药性有关3。而相比之下,关于气候变化的论文总数却已达到约 1.6 万篇。
任何类型的药物的研发过程都需要较高的成本,但是抗生素的开发尤其困难。抗生素药物的成本-效益比(投资能产生多少利润回报)远不如其他药物。英国埃克塞特大学的健康经济学家 Richard Smith 曾表示:“利润基本上就是成交量乘以价格。”然而对于抗生素药物来说,这两个要素都不够高,不足以弥补高昂的研发成本。
抗生素的价格之所以普遍较低是由于在许多国家,政府机构在药物价格评估方面发挥着极大的作用,而不仅仅是由制药企业定价。例如,英国国家健康与保健卓越研究院(NICE)会对新药的临床优势和成本效益进行评估。Smith 曾表示:“NICE 的工作目的之一就是努力保持药物的价格低廉。”
其他国家也有与之相类似的政策。例如在澳大利亚,一种新药要被纳入政府的药品福利计划中(纳入该计划的药物可以获得成本补贴),必须得到由卫生方面的专业人士和经济学家组成的委员会的批准,这一组织会评估这种药物是否物有所值。另外,加拿大政府也会对专利药物进行管制,使其保持较低的价格。
与此同时,为了延缓细菌耐药性的发展,医生正在尽量避免使用新抗生素。Smith 表示,这种做法意味着新抗生素溢价更加不被政府和卫生机构所接受。
他说:“在 20 世纪 60 年代,由于耐药性还不被视为一种较大的健康问题,抗生素的研发还能带来较高的利润。通常,一种药物将能够被授予 5~10 年的专利独占期,在独占期内,制造商可以免受与仿制药间的竞争之苦。但即便这样,售卖所获得的利润也不足以弥补高昂的开发成本。一旦独占期结束,其他制药企业就可以进入市场,且完全不用考虑研究所产生的成本,从而可以大大降低药物价格,比研发方更具优势。”
根据英国卫生经济办公室的一项政策回顾4,一个疗程的抗生素治疗周期较短,通常只有几周时间,因此可销售的数量较少。而一些慢性病的治疗需要几个月甚至几年。
2003 年的一项研究表明,注射用抗生素的利润为治疗癌症的药物的 1/3 左右,肌肉骨骼疾病药物的 1/12 左右5。

降低抗生素的开发成本可以作为提高抗生素利润的一种方法。但是随着微生物进化出越来越多的机制来逃避抗生素,新药设计的难度也不断增加,伴随而来的便是成本的增加。Wellcome 的耐药感染政策和宣传项目负责人 Jeremy Knox 对此表示:“我们已经失去了曾经的累累硕果。”
抗生素研究和开发(R&D)的临床前阶段最具风险,会造成最大的经济负担。这一阶段的成本占总成本的近 45%。产生如此高昂成本的原因是,许多较有前途的研究方法都没有成功,使得制药企业需要支付一大笔费用,却收获甚微。
传统上,抗生素的开发从寻找自然界中的抗菌化合物开始,这些抗菌化合物通常是由其他微生物合成的。然后再通过一系列的实验来观察它们是否能够量产,对人类是否安全,以及寻找其最合适的浓度。
但是,现在有人呼吁,希望研究人员使用更加先进且复杂的方法来加速这些早期开发环节,例如利用大数据分析,来降低抗生素的研究成本,使之能够获得更高利润。
在今年的一项研究中,科学家设计并训练了一个人工智能系统(AI)用于预测哪些分子有可能具有抗生素的特性6。该项目通过检索在线化学数据库,寻找到了一种叫做 halicin 的化合物,这种化合物虽然在结构上与传统的抗生素不同,但是仍能杀灭细菌。
今年 1 月,英国牛津的人工智能药物发现公司 Exscientia 使用了类似的方法制造了一种用于治疗强迫症的名为 DSP-1181 的药物。该公司表示,他们仅仅用了 1 年的时间就完成了平均需要 4.5 年的探索阶段。
此外,卫生保健部门还在试图改善对已经投入使用的非专利抗生素的管理。其中一个简单的方法就是轮换用药:当细菌对抗生素的耐药性达到阈值水平,医生就停止开此种药物,转而使用替代药物。经过 2~4 年的停顿期,耐药菌无法存活后,先前的药物便可以再次使用。
然而,一些尝试过此种办法的国家并没有达到设想的预期。20 世纪 90 年代,英国通过减少 98%包含磺胺类抗菌剂的处方,希望解决大肠杆菌的耐药性问题,但最后的结果是,大肠杆菌的耐药性仍然很高7。
瑞典所做的降低甲氧苄啶耐药性试验的最终结果也与此类似8。瑞典的科学家解释,是由于替代药物和甲氧苄啶的攻击机制非常相似而使得结果如此。因此,如果对替代药物有更多的预测研究,并掌握更多关于其效果的信息,比如确保它与所替代的抗生素有足够大的不同,那么这种药物轮换的措施就更有可能获得成功。
虽然人工智能技术能够使得生物学家更快地发现新型抗菌分子,可在抗生素上市之前,还有许多障碍需要克服。多哈卡塔尔大学的微生物学家 Susu Zughaier 表示:“这是一个充满困难的领域,你不仅要找到一种能够杀死细菌的新化合物,还要确保它能够稳定,对人体无毒,并能以低剂量工作,避免治疗后残留在肝脏和肾脏内。”

目前,一些制药公司已经放弃了抗生素的研究。例如,瑞士巴塞尔的诺华制药公司在 2018 年宣布停止抗生素的研究。该公司的首席执行官表示,公司的业务将专注于其他领域,如癌症治疗。同年,赛诺菲在巴黎发布了类似的声明。2016 年,阿斯利康在英国剑桥也发布了相关声明。目前,只有四家大型制药公司仍在积极开展抗生素的研究。
然而,一些规模较小的公司和慈善机构已经预见到,如果抗生素研发投资不足可能会引起的公共卫生问题。
在 2018 年,Novo Holdings 推出了一项名为“补充并促进抗感染药物研发流程(修复)”的融资方案。这项总价值 1.65 亿美元的计划将投资那些仍处于抗生素研发早期阶段的公司。该方案的目的不是为了盈利,而是通过确保新的想法得到落实以支持抗生素的研究。
Kutay 表示:“这是我们的第一支为了产生影响而牺牲一定自身利益的基金。我们的想法是在第一阶段为公司的抗生素研究提供资金,然后其他公司再从该公司手中接过接力棒,使得研发工作走向商业化。”
但是,在 2019 年,事情并没有向着预期发展。Novo Holdings 此前认为的会在早期投资结束后接手研发项目的大型制药公司,比如诺华制药,都决定放弃抗生素研究。还有些制药公司甚至直接宣布了破产。根据Novo Holdings 收集的数据,从 2018 年以来,抗生素药物公司的平均股价下跌了 71%,多家专注于抗生素研究的公司被迫申请破产。
2016 年,美国、德国和英国的政府以及一些基金会和慈善机构,包括 Wellcome 和华盛顿州西雅图的 Bill & Melinda Gates 基金会,成立了一个类似的项目,名为 CARB-X。该方案的预算甚至达到 5 亿美元。但是它遇到了一个相同的问题。
Knox 表示:“当我们成立 CARB-X 时,私人投资的数额仍然处在一个合理的范围内,但是在过去的两年,我们发现大家逐渐对这个项目失去信心。”
目前,仍不清楚这些资金能够支持抗生素研发工作多久,也不清楚政府或慈善机后能否提供进一步的帮助。Kutay 表示:“我们发现自己需要不断地为抗生素研发公司提供经济资助,但是这么做会消耗大量的资金,而且在抗生素开发的后期,仍然需要大量的资金。”
但幸运的是,产业界已开始对抗生素研发工作的经济问题作出反应。7 月,国际制药商和协会联合会宣布了抗生素耐药性(AMR)行动基金,24 家公司发表关于抗生素药物研发的倡议,其中包括 Novartis Holdings 和诺华制药。它的目标是在 2030 年之前,成功商业化 2 到 4 种新抗生素。迄今为止,已经承诺投入将近 10 亿美元以支持实现这一目标所需要的研究工作。
Knox 希望该基金能够帮助那些已经顺利从 CARB-X 和 REPAIR 等项目中“毕业”的初创企业。尽管资金的注入是一种较为有效的方式,但是使抗生素成为如此缺乏吸引力的市场力量仍然没有从本质上发生改变。

为了使得抗生素研发在没有外界非盈利资金资助的情况下仍然具有经济可行性,一些医疗保健品供应商和制药公司正在转向另外一种模式,即通过订阅的方式来支付抗生素的费用——买家将支付预先商定好的金额,并根据他们的需求使用药物。
Kutay 将这种模式称为 Netflix 模式。在这一模式下,买家将在开发的早期阶段向制药公司支付预付款,作为进一步开展研究的动力。
在英国,6 月开始了一项以这种方式支付某些抗生素的计划。卫生部长 Matt Hancock 表示,政府将向制药公司支付研发新型抗生素的所需费用,而不是按照每单位药片进行付费。英国政府将在今年年底前根据认购模式与制药公司签订两份合同。Hancock 在一份声明中说,这种支付方式“打破了限制性的壁垒,为企业提供了一个极为重要的跳板,以促进那些可能挽救生命的产品的创新和开发。”
这一举动受到了许多大型制药公司的欢迎,辉瑞公司(Pfizer)在纽约市表示,对这一消息感到“高兴”。但有些人对这一举措考虑得较为谨慎。英国牛津大学的健康经济学家 Laurence Roope 表示:“这是一项具有发展前景的举措,但需要始终与繁文缛节和官僚作风保持距离。”
有迹象表明,其他国家也在考虑采取类似的做法。2018 年,时任美国食品和药物管理局局长的 Scott Gottlieb 提出建议,希望政府医疗保健计划能够通过许可费来支付新抗生素研发的费用。
北卡罗来纳州达勒姆市杜克大学的研究员进行了一项政策审查,提出了关于这一举措实施的建议9。其认为政府机构应采取类似于英国的所做的举措,决定哪些药物有资格获得此项资格,以确保只有充分创新的抗生素研发才能从中获取收益,而不是施行一篮子政策。
Knox 认为,ARM 行动基金可能会推动其他国家采取 Netflix 模式。他说:“虽然我没有水晶球,不能够预测未来,但我认为这种模式会给政府施加更多压力,迫使他们采取相应的行动。因为此前政府能够通过转移视线,来回避问题。事实上,当 ARM 行动基金会宣布成立时,法国负责经济和财政事务的国务秘书 Agnès Pannier Runacher 承认十分有必要解决药物定价问题,且呼吁需要在欧洲层面解决这一问题。”
开发新抗生素的需求十分迫切,然而生产流程的“堵塞”现象仍然存在。为了解决这一问题,抗生素市场的经济状况需要重塑——这可能意味着政府必须付出更多的代价以减少抗生素的使用。Kutay 对此表示:“整个经济模式都被打破了。”
参考文献:
1.Towse, A. et al. Health Policy 121, 1025–1030 (2017).
2.Kuo, Y.-T. et al. Lancet Gastroenterol. Hepatol. 2, 707–715 (2017
3.Roope, L. S. J. et al. Science 364, eaau4679 (2019).
4.Sharma, P. & Towse, A. New Drugs to Tackle Antimicrobial Resistance: Analysis of EU Policy Options (OHE, 2014).
5.Projan, S. J. et al. Curr. Opin. Microbiol. 6, 427–430 (2003).
6.Stokes, J. M. et al. Cell 180, 688–702 (2020).
7.Enne, V. I., Livermore, D. M., Stephens, P. & Hall, L. M. C. Lancet 357, 1325–1328 (2001).
8.Sundqvist, M. et al. J. Antimicrob. Chemotherpy 65, 350– 360 (2010).
9.Schneider, M., Harrison, N. R., Daniel, G. W. & McClellan, M. B. Delinking US Antibiotic Payments through a Subscription Model in Medicare (Duke-Margolis Center for Health Policy, 2020).
原文链接:https://www.nature.com/articles/d41586-020-02884-3
作者|Benjamin Plackett
编译|Suzj
审校|617
编辑|笑咲


