
编者按:
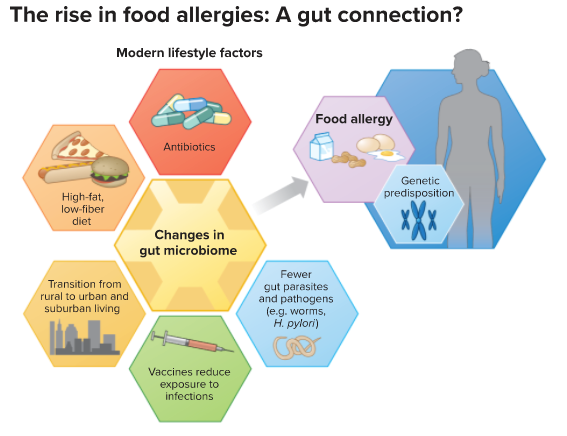
随着社会现代化进程的加速,越来越多人从乡村搬到城市中,越来越多人开始选择剖腹产,越来越多人经受过抗生素治疗,越来越多人开始摄入更多的加工食物。生活方式的巨大改变正在悄悄重塑我们的微生物组。
而微生物组的变化可能也在悄悄改变着人体的健康,比如过敏。近年来,过敏的发生率越来越高,而最近的研究发现微生物组或许是导致过敏的关键之一。
今天,我们将探讨肠道菌群与过敏之间的关系,并特别关注几家利用微生物疗法攻克过敏问题的初创公司。希望本文能够为相关的产业人士和诸位读者带来一些启发与帮助。
Nagler与过敏
小时候,Cathryn Nagler 一旦吃鸡蛋,脸上就会立即出现麻疹,而且她还对青霉素过敏。大学毕业后,在实验室工作的她,对小鼠也有着严重的过敏反应。小鼠会导致她出现哮喘、肿胀和呼吸困难等过敏症状,这些过敏反应严重到让她两度被送进急救室。
现在,Nagler 是芝加哥大学的一位免疫学家,她正在开辟一个新兴的研究领域:探究如何利用肠道中的细菌来帮助食物过敏的人。
然而,激起她兴趣的并不是她的个人经历,而是 20 世纪 80 年代,当她还是一个医学生时,观察到的奇怪现象。
当时她正在研究免疫系统失常的小鼠,这些小鼠的免疫系统会攻击自身关节中的胶原蛋白,从而导致严重的关节炎。科学家们通过在皮下注射胶原蛋白来迅速诱发这种疾病。但是,奇怪的是,当 Nagler 通过胃管给动物喂食胶原蛋白时,却出现了相反的效果:小鼠的状况变好了。

图. Cathryn Nagler 与研究技术员 Elliot Culleen 讨论实验。
食物过敏治疗的新方法
据估计,过敏影响着美国约 3200 万人口,平均每个班级中就 2 个孩子患有食物过敏。过去几十年,一种被称为 “口服免疫疗法”的方法,已逐渐被用于治疗食物过敏。
一些医师开始规律地使用小剂量的刺激性食物(或者用它们做的产品)来治疗过敏。一月份,美国 FDA 批准了一种用于治疗花生过敏的胶囊。
但是,口服免疫疗法也存在缺点。由于这种疗法包含可能会“致死”的食物,所以会让人感到紧张。而且这种疗法也不是对每个人都有效,对于潜在的疾病疗效甚微。此外,真正的成功要求很高,它意味着对过敏原食物耐受,例如能够安全的吃一些花生,而不是不再对花生粉产生过敏反应。
对于一些家庭来说,获得适度耐受的能力会改变生活。但是,这仍存在不确定性:获得一定的耐受能力后,患者也必须每天都吃一点这个食物,或者一周吃几次,否则他们可能会失去这种保护。
所以,Nagler 和一些其他的研究人员正在寻求一些治疗食物过敏更为简单和持久的方式。他们瞄准了他们所认为的根本原因——我们肠道中有益细菌或微生物组的失衡,他们认为这可能是重置免疫系统的希望。
开发一种以微生物组为基础的治疗方法极具挑战,很多细节都需要探讨并解决,比如需要提供哪些微生物,怎么样才能更好地传送它们,但是这类方法势头正盛。
去年,Nagler 的团队和另一个波士顿的团队报道了一个重要的进展:通过给有过敏倾向的小鼠提供来自健康不过敏的人类婴儿肠道微生物组,他们阻止了小鼠发生严重的过敏反应。
“这些数据掷地有声,非常令人鼓舞。”克利夫兰诊所的小儿科过敏专症医师 Jaclyn Bjelac 说。
而今年 3 月,科学家们发现,过敏患者的胃肠道中存在大量针对花生过敏原的抗体,这进一步支撑了这一观点——胃肠道是食物过敏调控和治疗的焦点。有一些公司已经在进行一些相关方法的测试了。
关于该研究《热心肠日报》做过相关解读:
Science子刊:花生过敏患者的胃肠道IgE+ B细胞
Science Immunology——[10.551]
① 对19名花生过敏患者血液、胃、十二指肠及食管中的IgE+ B细胞进行高通量测序分析;② IgE+ B细胞富集于胃及十二指肠中,并具有浆细胞表型;③ 90%以上的总B细胞克隆或IgE+ B细胞克隆仅可在单一组织中检测到,且IgA+ B细胞与IgE+ B细胞具有相似的体细胞突变模式,提示胃肠道IgE+ B细胞可能由胃肠道IgA+ B细胞经抗体类别转换而产生;④ 不同患者的花生过敏原Ara h 2特异性IgE抗体的序列高度相似,提示相似的抗体基因重排促进了花生过敏的发病。
Origins and clonal convergence of gastrointestinal IgE+ B cells in human peanut allergy
03-06, doi: 10.1126/sciimmunol.aay4209
【主编评语】IgE通过激活肥大细胞及嗜酸性粒细胞介导食物过敏。Science Immunology上发表的一项最新研究,对19名花生过敏患者的血液、胃、十二指肠及食管中的B细胞进行测序分析后发现,IgE+ B细胞富集与胃肠道中,且可能是由胃肠道中的IgA+ B细胞经抗体类别转换而产生。同时,在不同患者中可检测到高度相似的花生过敏原特异性IgE抗体序列,提示这类致病性IgE序列或可作为预测花生过敏的生物标志物。(@szx)
实际上,为什么有人对某种食物耐受,而另一些人却对其过敏,一直是个未解之谜,但是,就像 Nagler 合著发表于 Annual Review of Immunology 上的一篇文章提到的1,她坚信微生物就是关键。
假设的诞生:细菌是保护核心
在完成研究生学业的四年后,Nagler 开始在哈佛医学院运营一个实验室。她当时正在研究炎症性肠病,而非食物过敏。但是,上世纪 90 年代的研究表明,炎症性肠炎主要是由针对肠道细菌的免疫反应导致的,因此她的注意力转移到了微生物上。
然后,在 2000 年,她无意中发现了一项有趣的研究。该研究描述了模拟人们花生过敏的主要症状的老鼠模型。这些老鼠会疯狂抓挠,它们的眼、口会出现肿胀,其中一些还会出现呼吸困难——一种危及生命的过敏反应,名为全身性过敏反应。
所有的这些都在老鼠被研究人员喂食花生粉之后发生。“那吸引了我的注意。”Nagler 说。这这与她的发现相反,她早前发现喂食小鼠胶原蛋白可以缓解免疫反应。为什么会出现差异呢?
另一项报告表明,花生过敏的小鼠存在基因缺陷,这种基因缺陷会导致存在于免疫细胞膜并能辨识微生物的 TLR4 受体被破坏。这提示我们花生过敏的小鼠缺少肠道微生物和免疫细胞之间的正常交流。
“那是我灵光一现的时刻。”Nagler 说。在我们身体里生存的数万亿的微生物或许可以通过刺激 TLR4 受体来抑制机体对食物的免疫反应。也许是微生物组的紊乱改变了抑制作用,导致过敏。
这一想法与历史趋势相符。随着社会现代化的进程,人们搬到城市中,有了更多剖腹产出生的孩子,使用了更多的抗生素,更多地摄入精加工、低纤维的食物——这一切都重塑了微生物组。这些生活方式转变的时机与观察到的食物过敏及其他过敏的增加是一致的,这一代人中过敏的异常增加指向了一些环境因素。
2004 年 Nagler 和她的同事发表了一项报告,该研究表明,花生只在 TLR4 受体突变的小鼠中引起过敏反应,而在 TLR4 基因正常的小鼠中并不会引起过敏反应2。
当科学家们用抗生素清除了肠道菌群之后,这种差异消失了,而且,清除肠道菌群后,即使是正常的小鼠也会出现食物过敏,这表明细菌正是这种保护作用的核心。
从那时起,Nagler 的实验室一直致力于研究确认哪些细菌是有用的,并去理解它们如何调控过敏反应。
图片来源:O.I IWEALA & C.R. NAGLER / AR IMMUNOLOGY 2019
早期影响:预防窗口期
在他们的研究工作中,Nagler 的团队聚焦于梭状芽孢杆菌和拟杆菌——人类肠道中的两个主要菌属。通过研究在无菌环境中出生的无菌小鼠,该团队发现,将梭状芽胞杆菌移植到无菌小鼠肠道时可以阻止食物过敏反应,而拟杆菌则不能3。
可能的解释是:有梭状芽孢杆菌定殖的小鼠拥有更多的调节性 T 细胞,这是一种可以抑制免疫反应的细胞。这类小鼠也会产生更多的 IL-22——一种增强肠道内壁的物质。
这就形成了一个新的理论:如果保护性的细菌缺失,那么肠道屏障会减弱,使食物蛋白进入血液循环并可能激发过敏反应。这一推论与另一个有趣的观察结果非常吻合。
最常见的食物过敏(牛奶、鸡蛋、花生、坚果、大豆、小麦、鱼和贝类中的特定蛋白)彼此之间在生物化学上几乎没有相似性,但是它们之间存在一个共同之处。一般来说,消化道会把食物破碎成机体可直接吸收的营养素颗粒,而这些物质能够在消化道中保持完整结构。
“这样看来,花生更胜一筹——它在肠道中抵御分解的能力更强。”Nagler 说。
研究已经进一步确定了肠道菌群与食物过敏之间的联系,这些研究表明,微生物组的影响在生命早期就已出现。研究人员分析了健康婴儿和对鸡蛋或牛奶过敏的婴儿的粪便,发现过敏和不过敏的婴儿有着不同的肠道菌群组成4。
另一项研究追踪了 226 名牛乳过敏的儿童,追踪周期从婴儿时期到 8 岁5。科学家们发现, 长大后不再过敏的儿童,与另一些长大后仍会过敏的儿童相比,在 3~6 个月时,前者粪便中特定细菌(包括梭状芽孢杆菌)丰度更高。
此外,科学家们并未看到大一些的婴儿中出现同样的差异,这表明,预防过敏的微生物可能只在生命早期过程中发挥作用。
该研究领导人,纽约西奈山的伊坎医学院儿科过敏医师 Supinda Bunyavanich 说:“所有这些都指向了针对预防的窗口期的概念。”
图. 梭状芽胞杆菌的彩色扫描电子显微照片。该细菌生活在哺乳动物的肠道内,某些梭状芽孢杆菌与预防食物过敏有关。
因果关系证明
从出生开始,我们的免疫系统就在生死抉择中得到训练。它们学习如何杀灭细菌、肿瘤和凋亡的细胞。除了周围的环境,它们必须学会“顺其自然”——适应摄入的神经纤维、骨骼组织、牛奶中的蛋白质和零食时间吃的饼干。
Nagler 的实验室和另一团队于 2019 年发表的动物实验更有力地论证了肠道菌群培养了这种关键的免疫决策能力6。
在这项研究中,Nagler 和同事从健康婴儿和对牛奶过敏的婴儿粪便中采集了肠道菌群,并把采集的微生物移植到无菌小鼠的消化道中。结果,他们发现健康婴儿的肠道菌群能够保护小鼠免于出现对牛奶的过敏反应,而过敏的婴儿微生物不能。
该团队利用统计学和计算机科学技术分析了实验结果,他们确定了在健康婴儿中存在,而在过敏婴儿中不存在的细菌菌株。他们也测试了肠道内壁细胞的基因表达情况——特定的基因模式是健康肠道屏障的特征,并找寻了与健康屏障作用存在关联的微生物。
一种梭状芽孢杆菌(Anaerostipes caccae)在两项分析中脱颖而出。当科学家们将 Anaerostipes caccae 单独转移到无菌小鼠中时,出现的保护作用与移植完整健康的微生物组产生的保护作用类似。
另一个由波士顿儿童医院 Rima Rachid 和 Talal Chatila 领导的团队采取了类似的方法,他们使用了超敏感的小鼠,结果发现一个单一菌株Subdoligranulum variabile 和一组梭状芽孢杆菌可以预防过敏反应。而调节性T细胞是这种反应的关键,这种细胞受微生物刺激发挥作用。
关于该研究《热心肠日报》做过相关的报道:
Nature子刊:菌群疗法诱导特定T细胞,或是治疗食物过敏新策略
Nature Medicine——[30.641]
① 食物过敏(FA)婴儿的肠道菌群失调并随时间演变,梭菌目成员尤受影响,特别是S. variabile,FA菌群无法保护小鼠抵御FA;② FA中对肠道菌群的免疫应答异常,粪便菌群结合的sIgA减少、IgE增多;③ 联用6种梭菌属细菌,或5种免疫调节性拟杆菌目细菌,或单独用S. variabile,可改善粘膜免疫应答,抑制小鼠FA,而口服丁酸无效;④ 细菌治疗通过MyD88依赖性的方式,促进生成ROR-γt+ Treg,从而抑制FA;⑤ FA婴儿和小鼠中这类Treg水平显著降低。
Microbiota therapy acts via a regulatory T cell MyD88/RORγt pathway to suppress food allergy
2019-06-24, doi: 10.1038/s41591-019-0461-z
【主编评语】食物过敏(FA)与肠道菌群失调相关,《Nature Medicine》上线的一项最新研究,对FA婴儿的肠道菌群特征进行了纵向分析,鉴定出菌群失调和肠道免疫异常的特征,在小鼠中验证了FA菌群的致病性,通过细菌疗法有效抑制了小鼠FA,并揭示出背后的生物学机制,表明ROR-γt+ Treg细胞在改善FA中具有关键作用,这些发现为深入理解肠道菌群在FA中的作用,以及开发菌群靶向疗法来治疗FA,有重要意义。(@mildbreeze)
“这些研究和其他研究清晰地表明,微生物组对预防食物过敏包括耐受性非常重要。”丹佛科罗拉多大学的研究营养学家 Carina Venter 说。她正在研究孕期母亲饮食、婴儿微生物组和湿疹过敏风险之间的联系。
但是,她也表示:“如何从多样性和具体菌株的角度看待微生物组,我们还没有头绪。”

图. 某些食物比其他食物更容易引起过敏,如鸡蛋、贝类、坚果、花生、大豆、鱼、牛奶和小麦等。这些食物彼此之间虽然非常不同,但都含有抗消化的蛋白质。
整体还是部分?
诸多的未知数使得希望开发出更好的治疗食物过敏方法的研究人员陷入窘境:提供一个完整的健康微生物组更好,还是只补充几个有益微生物更好?
Rachid 说:“我每天都在挠头思考这些问题。”她正领导一个测试前者可能性的临床试验。在这个小型实验中,花生过敏的成人需要吞服一片含有完整肠道菌群的药剂,这些细菌是经过非营利性粪便资源库 OpenBiome 预筛选自健康捐赠者的安全菌群。
这种方法,也就是我们熟知的粪便移植(FMT),虽然并未被 FDA 批准,但是越来越多地被用于严重的肠道紊乱的治疗之中,目的是通过植入健康平衡的微生物来修复失调的微生物组。
另一些试验同样也在进行中。通过利用波士顿团队鉴定的保护性菌株,加州拉荷亚的 Pareto Bio 公司正在开发一种活菌型产品来治疗食物过敏。
另一家公司,马萨诸塞州坎布里奇的 Vedanta Biosciences,正在开发一种益生菌胶囊,其中包括筛选具有刺激调节性T细胞能力的梭状芽孢杆菌的组合。Vedanta 正在通过将这种胶囊加入到花生过敏的成年人的口服免疫疗法中以测试该疗法的效果。
(关于 Vedanta Biosciences 公司,推荐阅读:团队宇宙最强,CNS频发,顶尖药企买单,这家菌群公司牛!)
第三家公司,澳大利亚墨尔本的 Prota Therapeutics 公司,正在对花生口服免疫疗法加上益生菌的组合治疗方法进行商业化——在他们的案例中,一株乳杆菌被指定用于胃肠道问题。
然而,给予来自捐赠者的完整微生物组并非毫无风险:4 名患者已经因为粪便移植入院就医,一名因粪便移植相关的严重感染而死亡。
所以一些研究人员认为,使用精准的菌株可能更好。尽管这样做可能会弱化有益作用,但是 Wayne Shreffler 表示:“你不太可能出现这些意料之外的问题。” Shreffler 就职于波士顿马萨诸塞州综合医院负责食物过敏中心,也正在领导 Vedanta 研究。
但是所有的菌群调控方法共同面临的一个挑战:当某人已经有了一个微生物组,即便是不健康的那种,那么此时应该如何让新的微生物定殖。
传统来说,患者接受抗生素治疗来帮助新的细菌获得立足之地,但是也许另有方法。Nagler 和芝加哥大学生物分子学工程师 Jeff Hubbell 共同创立的初创公司——ClostraBio 正在开发一种结合了活菌和丁酸盐(一种关键微生物代谢产物)的治疗方法。
“这种物质可以增强肠道屏障功能,还可能有抑菌的作用,这就能够给添加的微生物创造一个生态位。”Nagler 说。ClostraBio 公司计划在 2021 年开始它的第一个人体实验。
在接下来的几年里,研究人员将会了解更多如何利用微生物组来对抗食物过敏的知识。但是这并非易事。遗传学、饮食、环境暴露等等,所有都会影响过敏的风险。
“这是一个大的拼图。”Bunyavanich 说。微生物组只是其中的一块,但是她和 Nagler 以及其他的人都认为这会是很大的一块。
参考文献:
1.Iweala O I, Nagler C R. The microbiome and food allergy[J]. Annual review of immunology, 2019, 37: 377-403.
2.Bashir M E H, Louie S, Shi H N, et al. Toll-like receptor 4 signaling by intestinal microbes influences susceptibility to food allergy[J]. The Journal of Immunology, 2004, 172(11): 6978-6987.
3.Stefka A T, Feehley T, Tripathi P, et al. Commensal bacteria protect against food allergen sensitization[J]. Proceedings of the National Academy of Sciences, 2014, 111(36): 13145-13150.
4.Fazlollahi M, Chun Y, Grishin A, et al. Early‐life gut microbiome and egg allergy[J]. Allergy, 2018, 73(7): 1515-1524.
5.Bunyavanich S, Shen N, Grishin A, et al. Early-life gut microbiome composition and milk allergy resolution[J]. Journal of Allergy and Clinical Immunology, 2016, 138(4): 1122-1130.
6.Feehley T, Plunkett C H, Bao R, et al. Healthy infants harbor intestinal bacteria that protect against food allergy[J]. Nature medicine, 2019, 25(3): 448.
原文链接:https://www.knowablemagazine.org/article/health-disease/2020/could-gut-microbes-solve-food-allergies
作者|Esther Landhuis
编译|C。
审校|617


