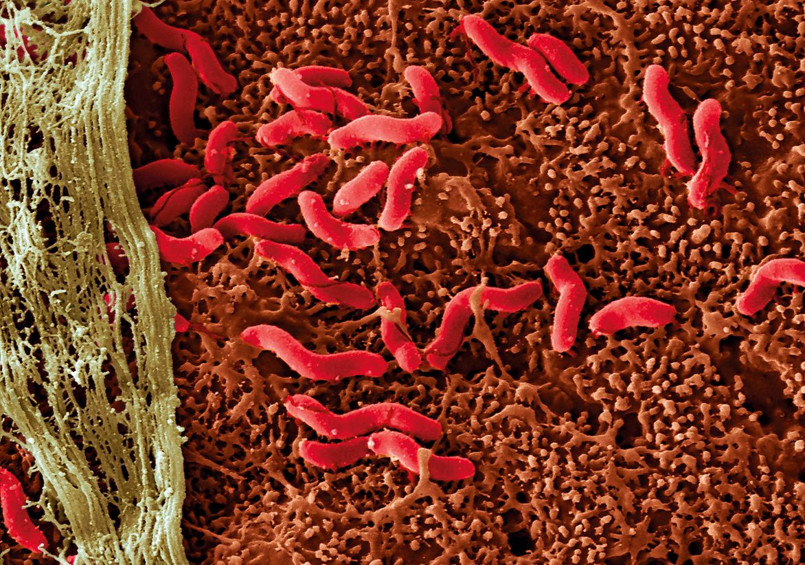
肠道表面幽门螺杆菌扫描电镜检查图片
来源:Eye of Science/SPL
昨天,我们发布了新一期 Nature Outlook 中人肠道微生物组研究概况、肠道微生物组的重点研究和寻找健康微生物组 3 部分的编译内容:Nature:肠道菌群研究六大热点?健康微生物组如何定义?
今天,我们关注肠道微生物与疾病之间的关系,发布以下内容的编译:“微生物抗癌”、“细菌药片能治疗自身免疫性疾病吗?”、“肠道菌群与自闭症相关吗?”
微生物抗癌
1984 年 7 月,一位年轻的澳大利亚胃肠病学家喝下了含有致病菌幽门螺旋杆菌的牛肉汤。没过一周,他开始呕吐,呼气有了异味,他高兴极了。
这位胃肠病学家叫做 Barry Marshall,他想要证明是幽门螺旋杆菌引发的胃粘膜炎,这是胃癌的初期征兆。通过对自己的胃组织进行活检,Marshall 证明了这类顽强的、螺旋状微生物可能会引发胃病。
21 年后,Marshall 和他的导师 Robin Warren 获得了诺贝尔生理或医学奖,以表彰他们发现了这种细菌与慢性炎症、胃溃疡以及胃癌等疾病的关联。
长期以来,幽门螺杆菌被视为一类特殊的传染性病原体,就像是人乳头瘤等病毒一样,能够引发肿瘤形成。在肿瘤学领域里,寄居在我们肠道、皮肤和其它组织中数以万计的微生物群绝大多数都被看作成了无辜的路人甲。
现在癌症研究人员意识到很多看似无害的微生物其实并非如此。过去的十年间相关研究逐渐明朗,研究发现肠道菌群能产生 DNA 损伤毒素和致癌代谢物质,诱发促癌炎症,引发肿瘤对化疗药物的耐药性和抑制机体抗癌免疫反应。
Susan Bullman,这位来自华盛顿州的西雅图弗雷德·哈钦森癌症研究中心的微生物学家表示:“现在似乎每天都有一些新的微生物会与癌症扯上关系。”
许多像 Bullman 这样的研究人员正竞相揭示肿瘤诱发菌背后的分子机制,以鉴定出用于风险评估、早期监测、预防和治疗的靶标。
还有一些癌症研究人员已经在测试以微生物组为基础的疗法能否改善现有抗癌干预措施的疗效和安全性。世界各地的肿瘤学家正借鉴胃肠病学家的经验开始给他们的病人进行粪便移植和使用细菌胶囊。
这些活体疗法已经彻底改变了抗生素耐药性肠道感染的治疗方式。一些研究也已经证明粪便移植在接受干细胞移植后的血癌患者中的潜力(这类人群必须服用广谱抗生素来预防感染,但是这样做他们也会损失用于抵御供体细胞侵袭宿主所必需的细菌)。
现在,研究人员正在寻找一类有益菌群,希望这些菌群能够增强像是检查点抑制剂这类免疫调节药物的有效性并减轻药物毒性。
“调节微生物组是完全可行的。”得克萨斯大学休斯顿 MD 安德森癌症中心的外科肿瘤专家 Jennifer Wargo 表示,“人们真正地接受了这类观点,我们正开始看到这些努力的早期成果。”

香港中文大学的微生物学家于君已经开始深入研究细菌在诱发胃癌中的作用。于的团队鉴定出少数微生物,它们在胃癌1和胃癌癌前病变患者的样本中富集。她表示,“幽门螺旋杆菌并不是唯一的坏人。”
于怀疑对幽门螺旋杆菌的关注是一次历史的偶然事件。这种微生物恰好能在实验室培养基中生长——这是自 20 世纪 80 年代以来细菌鉴定的标准技术。于的团队依靠的是 DNA 分析。
她表示:“基因测序提供了一个有力方法来鉴定在胃中的其它微生物,这些微生物也发挥了一定的作用,但是之前并未被发现。”现在她的团队正在小鼠模型上评估这些细菌诱发肿瘤的潜能。
(之前热心肠邀请过于君老师进行演讲:于君:5400 字详解大肠癌和菌群关系的 5 大问题!)
大肠癌作为世界范围内第 3 大常见癌症类型,也与肠道菌群有关。2009 年,发现一种叫作脆弱拟杆菌(Bacteroides fragilis)的肠道细菌产生的一类毒素与肠癌的发展相关。脆弱拟杆菌是幼儿腹泻病的病因之一2。
马里兰州巴尔的约翰霍普金斯大学的感染性疾病专家 Cynthia Sears 在小鼠上作出了创新性发现,证明了毒素能诱使免疫细胞进入小肠粘膜,引发炎症级联反应,从而导致癌症。
位于盖恩斯维尔的佛罗里达大学的微生物免疫学家 Christian Jobin 领衔的团队有同样的发现:大肠杆菌(Escherichiacoli)能够通过产生毒素损伤 DNA 诱发肠癌3。然而,这些病原体并不一定是孤立存在的。Jobin 表示:“它们是一群微生物的集合,能够共同影响基因组稳定性和免疫功能。”
Sears 提出了脆弱拟杆菌和大肠杆菌共同作用来刺激肿瘤生长这一观点的证据,她介绍肠癌遗传易感人群中通常在他们的结肠处有零星的细菌生物膜,这些生物膜主要由这两类微生物构成4。
尽管具核梭杆菌(Fusobacterium nucleatum)并未出现在 Sears 的研究中,但是有多种证据表明,这种在绝大多数人口腔中都能发现的梭状微生物也是肠癌驱动的主要因素之一。不过并非通过毒素这一媒介,具核梭杆菌似乎通过与小肠细胞直接互作来促进癌细胞增殖。
通过基于对肿瘤样本的测序研究,具核梭杆菌与癌症的关联首次浮现。就职于加拿大温哥华英属哥伦比亚癌症研究所的遗传免疫学家 Robert Holt,使用测序比较了 11 个大肠肿瘤与癌旁组织的 RNA 差异5。Holt 说,当他和同事寻找在肿瘤中表达水平升高的细菌基因时,“梭杆菌属表现的非常明显。”
与此同时,马萨诸塞州波士顿的丹娜—法伯癌症研究院的免疫学家 Wendy Garrett 和癌症遗传学家 Matthew Meyerson 领衔团队对肠道肿瘤进行了分析,无意中发现了同样的微生物6。
自此以后,来自捷克共和国、中国、日本和韩国的研究团队纷纷发现肠道肿瘤中有较高丰度具核梭杆菌的人群会有较差的生存结果。然而,其生物学意义仍未明朗。
Garrett 说:“如果你有梭菌属并患有晚期结直肠癌,这太糟糕了,因为你的疾病进展时间会更加短。但是为什么会这样呢?”
包括 Garrett 在内的科学家们对小鼠的研究表明具核梭菌的存在会加快恶性肿瘤的增长,这可能是通过调节免疫反应或者是直接激活癌症信号通路实现的。微生物似乎还能通过诱导细胞再循环过程增强化疗耐药性,这会提高肿瘤的药物存活率。其它的肿瘤定植菌还能够代谢化疗药物,从而进一步造成耐药性。
去年,由 Garrett 和 Meyerson 领导的一支国际团队获得了来自英国癌症研究所 2000 万英镑(2600万美元)的资助,以探究体内微生物到底是如何导致肠癌的。部分资金专项用于寻找在不扰乱整个肠道微生态平衡的前提下,消灭具核梭杆菌、脆弱拟杆菌和大肠杆菌等头号嫌疑者的新方法。
2017 年,正在 Meyerson 实验室工作的 Bullman 表示抗生素甲硝锉会减缓肿瘤中梭杆菌属阳性的小鼠的癌症进展7。但是抗生素也会攻击肠道中一系列有益菌群。
Bullman 说:“我们真正需要的是更有针对性的方法。”一种专门针对梭杆菌属的药物或许能做到这一点,也可能是一种疫苗,或者是能充分通过感染细菌来精确消灭有害微生物的噬菌体疗法。
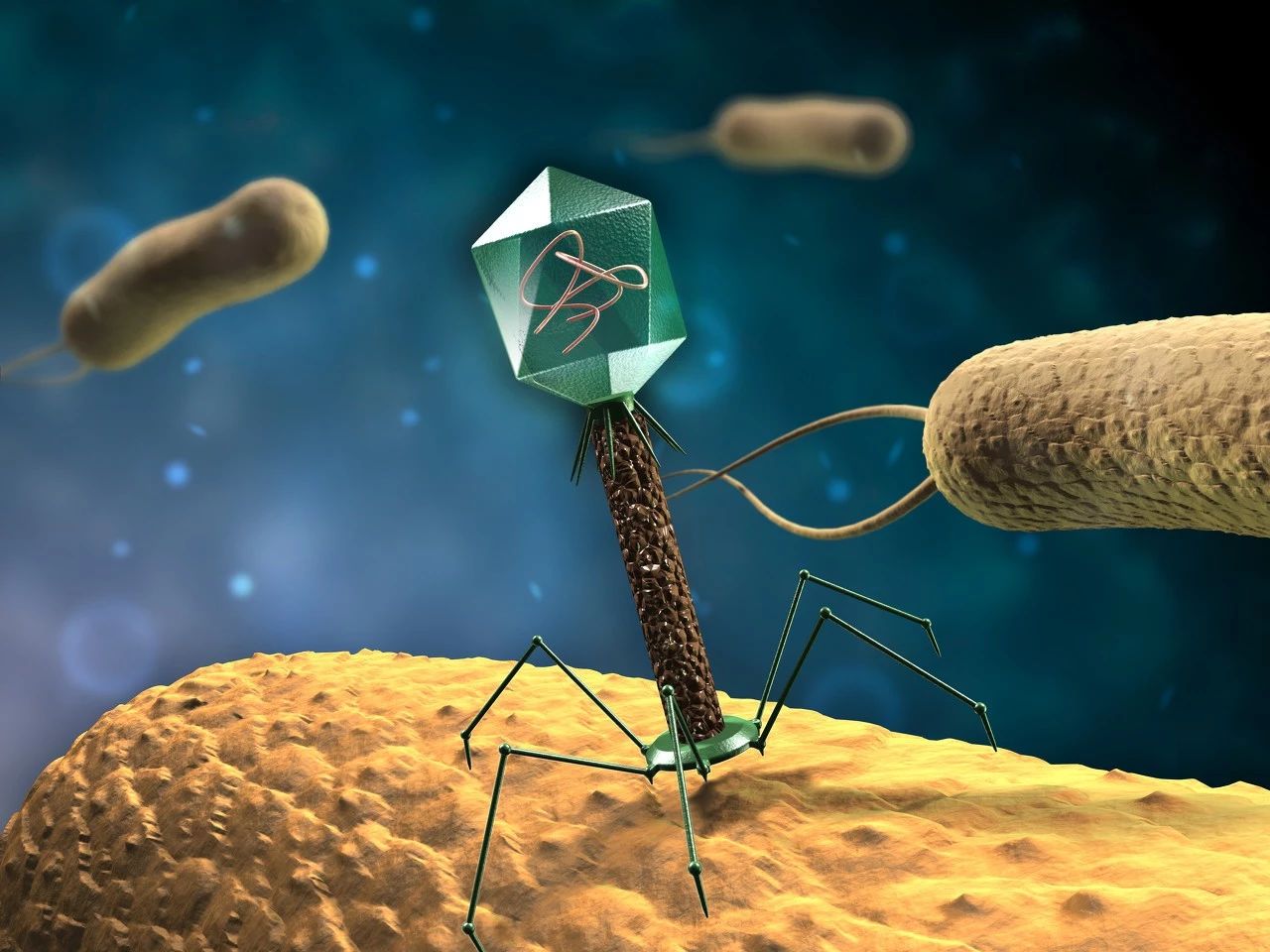
在巴黎举行的 2019 年国际癌症免疫治疗大会上,来自以色列耐斯兹敖那(Ness Ziona)的微生物组疗法公司 BiomX 的科学家们宣称发现了几株靶向梭杆菌属的噬菌体,当注射进小鼠的血液中后能够成功地侵染定植在肿瘤中的细菌。
据首席执行官 Jonathan Solomon 所述,BiomX 正利用合成生物学将噬菌体改造成可编程的细菌杀手,这样能够递送治疗有效载荷,从而有助于诱使抗肿瘤免疫细胞到达攻击位点。
另外,可以采用一种叫作蛭弧菌属(Bdellovibrio)的食肉细菌来对抗引发癌症的微生物——来自加拿大圭尔夫大学的微生物学家 Emma Allen-Vercoe 在寻找能消灭梭菌属的微生物上没有费很多力气。因为她的团队只是从大学钟楼前的草坪上挖了一片三叶草,然后进行分离。
Emma 表示,他们发现在噬菌微生物中有很多是杀灭梭杆菌的真正冠军。
尽管有这些成果,大部分专家坦诚这仍需要弄清楚人体微生物组与癌症是否有因果关系。有可能许多细菌只是在癌症发生后进行了机会性入侵。
伦敦帝国理工学院的结直肠外科医生 Alasdair Scott 说道:“我们缺乏关于微生物组诱发癌症的纵向队列研究的可靠直接证据。”
他是国际癌症微生物组大会的发起人之一,这一全球组织致力于建立微生物组在肿瘤学中的作用的专家共识。去年,该组织起草了一项政策文件呼吁研究人员解决因果性与相关性的问题8。
然而,前瞻性队列研究需要数年时间,现在需要新的癌症治疗方案。Holt 认为“你不用等到所有的事情都完全弄清后再说。”因此,临床医生正在推动测试微生物组的试验,尤其是在服用检查点抑制剂药物的患者上,这些药物旨在加快机体抗肿瘤免疫反应。
在 2019 年度的美国癌症研究协会会议上,两个研究团队展示了接受免疫疗法的黑色素瘤患者的可喜成果。在这两个案例中,最初并未从治疗中获益的患者在接受了对药物有反应的某些人群的粪便后,他们的肿瘤缩小了。
癌症患者在服用抗癌药物的同时或许会获益于微生物疗法
图片来源:Olivier Asselin/Reuters
在其它方面,伴随免疫疗法的同时研究人员业已使用来自健康供体的粪菌制剂,结果也同样令人满意。而且,考虑到这种方案通常被认为是低风险的,许多临床医生正开始考虑未来将粪便移植作为所有免疫治疗病人的标准附加疗法,而并不仅仅是针对那些刚开始对免疫靶向药物表现不佳的人群。
John Lenehan,这位加拿大伦敦区域癌症项目的肿瘤学家表示“或许每个人一开始就应该这样做。”
然而,去年当研究人员报道了受污染的粪便是如何造成一人死亡以及在调查另一项应用流程的实验测试中造成额外的严重疾病后,粪便移植的安全性受到了质疑9。
现在,内科医生会对供体样本检测,确定是否存在能引发感染的耐药性菌株大肠杆菌。但是担心新的致命微生物可能会躲过筛查过程,许多研究人员正转向使用鉴定过的、特性描述完善的以及能在实验室中生长的菌群配方。
这类可培养菌株的混合物通常会根据人体观察研究和小鼠试验检测进行筛选,以选择哪些微生物能最大限度地影响免疫治疗反应。
例如,Wargo 领导的一个团队介绍了检查点抑制剂临床反应与肠道菌群组成之间的相关性。位于马萨诸塞州剑桥市的微生物组公司 Seres Therapeutics 利用这些成果,结合额外的内部数据开发了一款菌株复合剂,由几十种细菌构成,均以孢子形式存在。包括 Wargo 在内的研究人员业已开始在晚期黑色素瘤患者身上测试 Seres 产品。
同样是位于剑桥的微生物疗法公司 Vedanta Biosciences 通过在人体粪便菌群中寻找在小鼠上最能有效激发预期免疫反应的微生物,最终挑选了11株用于复合菌剂的细菌10。包括 Vedanta 的科学家在内的团队展示了在小鼠模型中每株菌是如何单独增强抗菌或抗肿瘤免疫的。
研究的共同作者同时也是 Vedanta 的首席执行官 Bernat Olle 表示:“ 然而,在某些组合的配方中,它们效果更显著。”
包括位于英国利兹市制药公司 4D Pharma 在内,许多公司正进一步简化治疗方式并采用具有免疫刺激功效的单菌株。
该公司的科学家介绍了一株分离自健康人体肠道的鸡肠球菌及其鞭毛结构蛋白,它能通过与位于小肠细胞上的受体互作激活免疫系统。公司正在患有肺癌、肾癌、膀胱癌和皮肤癌的患者对这种菌株进行临床检测,同时作为肿瘤移除术前的治疗方式与检查点抑制剂联用。
加拿大多伦多总医院研究所的感染性疾病专家 Bryan Coburn 指出了不依赖供体粪便而是使用优化设计后的细菌组合的几项好处。Coburn 表示:“我们清楚地知道里面有什么,所以会有明确的安全性优势。”
他正在做一款用于癌症的多菌株制剂临床评价,该药是由来自位于纽约州铂尔里弗的 NuBiyota 公司开发的并受到了圭尔夫的 Allen-Vercoe 的共同资助。Coburn 表示,拟定好的配方是可以扩展和改进的。
此外,他还补充道:“通过该方法,我们可以获得包括评估效价在内的,难以在粪菌移植中评估的指标。”
微生物疗法或许在特定肿瘤类型上也需要调整。例如,对检查点抑制剂有应答的转移性前列腺肿瘤患者,在其粪便中 Akk 菌(Akkermansia muciniphila)水平低于无应答患者。但是在肺癌和肾癌患者中情况正相反—其肠道中有更多Akk菌的人群在治疗中表现得更好。
Amy Moran, 是一名波特兰市的俄勒冈州健康与科学大学的免疫学家,她认为患有不同癌症的病人接受的不同治疗方式或许可以解释这种差异。她说:“这些病人服用的许多不同类型的药物或许正在影响微生物组的构成。”
对于前列腺癌,她猜测通常用于一线治疗的激素疗法或许是罪魁祸首。在这种情况下不确定哪种细菌表现最佳,所以,Moran 与其同事正开始准备尝试使用完整的粪菌移植来激发免疫治疗反应。
在肿瘤临床的其它方面,研究人员正采用微生物组疗法来管理许多由检查点抑制剂药物引发的,与免疫相关的毒性。
在得克萨斯大学 MD 安德森癌症中心,胃肠病学家王英红(音译)正使用粪菌移植来治疗免疫疗法引起的结肠炎。
在 2018 年,她报道了一位患有膀胱癌的女士和前列腺癌的男士,两人在接受了检查点抑制剂后产生了包括血便在内的副作用,但他们在接受了一至两次来自健康供体的粪便移植后症状得以解决11。
此后,王又治疗了十几位病人。她说:“似乎所有人都能从这种疗法上获益。”
王的病人之前并未接受过粪菌移植来改善治疗反应。她推测如果之前他们接受过粪菌移植一开始就不会产生副作用。因此,调节微生物组对癌症患者或许是一箭双雕——在增强其它药物响应率的同时,也能防范药物最坏的影响。
本部分参考文献:
(滑动下方文字查看)
1.Coker, O. O. et al. Gut 67,1024–1032 (2018)
2.Chung, L. et al. CellHost Microbe 23, 203–214 (2018)
3.Arthur, J. C. et al. Science 338,120–123 (2012)
4.Dejea, C. M. et al. Science 359,592–597 (2018)
5.Castellarin, M. etal. Genome Res. 22, 299–306 (2012)
6.Kostic, A. D. et al. GenomeRes. 22, 292–298 (2012)
7.Bullman, S. et al. Science 358,1443–1448 (2017)
8.Scott, A. J. et al. Gut 68,1624–1632 (2019)
9.DeFilipp, Z. et al. N.Engl. J. Med. 381, 2043–2050 (2019)
10.Tanoue, T. et al. Nature 565,600–605 (2019)
11.Wang, Y. et al. NatureMed. 24, 1804–1808 (2018)

神经科学家 Egle Cekanaviciute 发现,多发性硬化患者的肠道微生物组与未患此病的人不同。
图片来源:SUSAN MERRELL/加州大学旧金山分校
细菌药片能治疗自身免疫性疾病吗?
对纽约大学的风湿病学家 GreggSilverman 来说,他为一位女病患治疗狼疮的那天,是一个转折点。
那天,这位女性的同卵双胞胎妹妹来探望她。这个妹妹身体十分健康,怀里还抱着她一岁的孩子。与此同时,Silverman 治疗的这位女性患者正在接受肾脏透析,尽管他尽了最大努力,但她的病情依然在恶化。
“遗传学并不能解释这种差异。” Silverman 说。这一发现让他开始了长达数十年的探索,寻找这种令人费解的自身免疫性疾病的其他原因。
研究其他自身免疫性疾病的研究人员也将目光投向遗传学以外的领域。加拿大多伦多病童医院的遗传学家 Jayne Danska 说,在 Ι 型糖尿病的病例中,流行病学证据是压倒性的。
她说:“遗传学不能解释为什么在过去 50 年里,Ι 型糖尿病在许多不同国家的发病率是一直上升的,也不能解释为什么发病年龄越来越早。”
许多因素,包括病毒感染和某些食物,长期以来一直被怀疑会引发自身免疫性疾病,即机体攻击自身的细胞。但在过去的十年里,新的“嫌疑人”出现了——数以万亿计的栖息在消化道中的微生物。科学家们现在发现肠道微生物与许多自身免疫性疾病有关,包括狼疮、Ι 型糖尿病、类风湿性关节炎和多发性硬化症。
例如,2017 年,加州大学旧金山分校的研究人员将多发性硬化症患者的肠道微生物组与健康志愿者的肠道微生物组进行了比较。这项由遗传学家 Sergio Baranzini 和神经学家 Egle Cekanaviciute 领导的研究发现,在这两组样本中,许多微生物的数量都存在很大的差异。
Cekanaviciute 说:“这项研究不仅发现了微生物群落的差异,而且实际上表明了它们在人体免疫系统中的生理意义。”他现在在美国宇航局艾姆斯研究中心(位于加利福尼亚州莫菲特菲尔德)研究微生物组对健康的影响。
与健康人相比,有两种菌株在多发性硬化症患者肠道内更为丰富。把它们分离出来,与人血细胞共同体外培养,细胞的炎症反应升高。另一种菌株,其水平在多发性硬化症患者中较低,可以刺激抗炎细胞。
当研究人员将一个多发性硬化症患者肠道内的微生物组移植到无菌小鼠肠道内时1,“这些小鼠比接受健康人的肠道微生物组的小鼠虚弱得多。” Baranzini 说。
肠道微生物组拥有触发或维持自身免疫状态的能力,科学家们正试图了解这种表观现象背后的机制。他们希望将这些知识转化为更好的治疗方法,来治疗目前难以治疗的疾病,甚至可能是以简单的益生菌药片的形式。

自身免疫性疾病的部分原因是人类白细胞抗原(HLA)基因复合物的改变。而 HLA 基因复合物是适应性免疫系统的基石,它可以识别和记忆特定的病原体。
HLA 基因表达蛋白质,向免疫系统的 T 细胞和 B 细胞呈递抗原。免疫细胞随后识别并攻击携带这些具有抗原标志的危险“入侵者”。T 细胞和 B 细胞会忽略自身的细胞,但在自身免疫性疾病中,它们无法忽略自身的细胞,也就是它们会对自身的细胞产生攻击。
尽管大多数 T 细胞在胸腺中,但也有少数 T 细胞是在肠道中被训练如何忽略自身的蛋白质。意大利米兰 IRCCS 圣拉斐尔医院的免疫学家 Marika Falcone 解释说:“考虑到所有不同的与肠道接触的环境因素,你的肠道需要获得大量的免疫耐受。”
Danska 说,用特定微生物在无菌小鼠肠道内定植的实验表明,肠道微生物会影响整个免疫系统。反过来,免疫系统也会影响肠道内的微生物。生物学家们正在探索肠道微生物组促炎或抑炎的各种可能机制,这些机制可能关于微生物本身、微生物的代谢产物、微生物“训练”的免疫细胞,或者其他驱动机制。
一个问题是,微生物之间巨大的遗传差异是否会导致免疫细胞混淆什么是外来的,什么是自身的。一项汇集 3665 人的(粪便)样本进行的 meta 分析,确定了 2200 多万个肠道微生物的基因2。这些基因产生的蛋白质被人体的免疫系统仔细检查,绝大多数蛋白质都是无害的或容易处理的。
但有的微生物蛋白质含有与人的蛋白质相似的片段,这会引起人体免疫细胞的警觉。康涅狄格州纽黑文市耶鲁大学的免疫生物学家 Martin Kriegel 说,每个个体的微生物组的基因数量大约是我们自己基因组的 100 倍,如果有相似的片段也不足为奇。
因此,理论认为,微生物就是这样“教会”了免疫系统:人类蛋白质是威胁的信号。Baranzini 说:“在这种分子模拟的情况下,免疫系统会变得混乱。它开始对微生物产生反应,最后它会对我们自己的蛋白质产生反应。”
Kriegel 和他的同事通过一种与人类蛋白质 Ro60 非常相似的细菌蛋白演示了狼疮患者体内的分子模拟机制3。分子拟态也可能在类风湿性关节炎中起作用——由肠道微生物如普雷沃菌属产生的肽,与患者关节免疫系统中的肽非常相似。
在 2017 年的一项研究中4,微生物肽产生的免疫反应与匹配的宿主肽的免疫反应一致,“这是一个相当有力的现象。”波士顿马萨诸塞州总医院的风湿病学家、该研究的作者 Allen Steere 说。
多发性硬化症患者脊髓的显微照片。
图片来源:Riccardo Cassiani-Ingoni/SPL
如果肠道微生物组确实让免疫系统感到困惑,那么问题仍然是这种自身免疫反应是如何从肠道传播到全身的呢?在某些情况下,特定的细胞受到影响,例如多发性硬化症的神经细胞和 Ι 型糖尿病的胰腺 β 细胞。但在狼疮和类风湿性关节炎中,自身免疫反应发生在多个器官。
Steere 和他的同事在一些类风湿关节炎患者的关节中发现了普雷沃菌属的 DNA 4。Steere 说,这一发现表明,要么是微生物本身,要么是免疫细胞携带的微生物残留物,进入了关节。
针对多发性硬化症的病例,纽约城市大学的神经学家 Patrizia Casaccia 表示:“我认为不是微生物移动了,而是它们的代谢产物移动了。”
她指出,代谢产物可能通过迷走神经发出信号,而迷走神经可以将信息从肠道传输到大脑。但在另一些情况下,微生物本身就存在于受影响的器官,例如 Ι 型糖尿病的胰腺。
Kriegel 和他的团队表明,在易发生狼疮样症状的小鼠中,鸡肠球菌会从肠道转移到其他器官,包括肝脏,在那里它们会引发免疫级联反应,最终导致狼疮5。研究人员还在人类肝细胞中发现了类似的生物通路。最重要的是,Kriegel 说,大多数狼疮患者的肝活检中都发现了这种微生物,但健康人的肝活检中却没有。
他的研究团队还表明,抗生素治疗或针对鸡肠球菌的疫苗都能阻止小鼠自身免疫性疾病的发展。Kriegel 说:“人们已经可以设想一种潜在的未来疗法,这种方法将针对这些跨越肠道屏障的病菌。”
有关粪菌移植(FMTs)或益生菌药片的报道给了免疫疾病患者希望:有一种简单的方法可以预防或治疗他们的疾病。科学家也有同样的愿望,但值得注意的是,FMT 和益生菌药片的临床研究才刚刚开始。
例如,对于多发性硬化症,最终的治疗方法可能会“像针对性的饮食干预一样简单,将肠道微生物从促炎型转变为更多的抗炎型”,Baranzini 说。为了实现这一目标,他的团队正在进行一项小规模的 FMT 一期临床试验,以评估其安全性和副作用。
Casaccia 强调谨慎行事的重要性。她说:“我们想了解调控肠道微生物群落的机制,也许我们可以开发一种健康益生菌和益生元的组合,以支持有益菌的生长,饮食调控也可能会有助于这一点。但我不确定我们是否已经达到了可以这样做的水平。”
研究人员确实看到了重大进展。Danska 说:“过去 20 年来,人们使用各种手段所付出的巨大努力已经开始见效。”。她的团队建立了一个平台来识别血液中抗菌的抗体。该平台分析了 Ι 型糖尿病高危儿童的样本,揭示了患病与抗体之间的重要线索6。
Danska 希望,对肠道微生物组有更好的了解,特别是生命开始 3 年的肠道微生物组,这将对疾病预防的干预措施有决定性作用。
她说,这可能包括给婴儿提供特定的微生物成分,使儿童的免疫系统“在不牺牲抗感染能力的情况下,以最佳的自我耐受能力发育。这种疗法可能会产生全球性影响,因为菌株很便宜。如果我们连小熊橡皮糖中的微生物组都能确定,那就好了!”
本部分参考文献:
(滑动下方文字查看)
1.Cekanaviciute, E. et al. Proc. Natl Acad. Sci. 114,10713–10718(2017).
2. Tierney, B.T. et al. Cell Host Microbe 26, 283–295 (2019).
3. Greiling, T.M. et al. Sci. Transl. Med. 10, eaan2306 (2018).
4. Pianta, A.et al. J. Clin. Invest. 127, 2946–2956 (2017).
5. ManfredoVieira, S. et al. Science 359, 1156–1161 (2018).
6. Paun, A. etal. Sci. Immunol. 4, eaau8125 (2019).
患有自闭症谱系障碍的儿童在午餐时使用符号进行交流。
图片来源:BSIP/UIG
肠道菌群与自闭症相关吗?
在 Ethan Loyola 过他第一个生日之前,很明显他的肠胃出现了问题。在他还是个婴儿的时候,他曾接受过数个疗程的抗生素治疗以对抗严重的耳部感染。此后,他经历了恶臭的酸性腹泻,这让他痛苦地抽搐。大约 1 岁的时候, Ethan 开始说不出话,也不再与人对视。不久之后,他被诊断为自闭症谱系障碍(ASD)。
随着 Ethan 年龄的增长,他的消化问题并没有消失。而且在特殊情况下,或者是在人群中他会感到痛苦。“他用手捂着耳朵,不想在人群中。”他的母亲 Dana Woods 说,“太让人无法忍受了。”
接着,Ethan 的父亲看到一张钉在自闭症治疗诊所墙上的传单。坦佩市亚利桑那州立大学的科学家们正在寻找自闭症儿童,尝试一种名为“微生物组转移疗法”的实验性治疗方法。Ethan 的父母为他报名了这项研究。
ASD 会导致各种语言和社会困难。全球每 160 名儿童中就有 1 名患有该病,但是该病的治疗进展缓慢得令人沮丧。一些家长长期以来声称,改变孩子的饮食或给他们补充益生菌不仅能改善消化问题,还能改善行为症状。
现在,研究人员发现,除了能够帮助消化,肠道菌群还能产生生物活性化合物帮助协调大脑功能和社会行为发展。研究表明,患有自闭症的儿童与正常儿童的肠道微生物组不同。在动物实验中,当正常种类的肠道菌群缺失时,就会出现类似自闭症的症状。
尽管离下定论还远,但是这些发现促使研究人员开始探索肠道微生物和自闭症症状之间的联系,并且开始试验 ASD 治疗方法——恢复肠道微生物。
爱尔兰科克大学的生物化学家 John Cryan 是首批研究肠道微生物如何影响社会行为的研究人员之一。2014 年,他发现无菌小鼠,也就是那些缺乏典型肠道微生物的小鼠会回避其他小鼠,以及新的社交场合,并且会过度打扮自己1。
Cryan说:“这暗示着微生物组参与了行为的许多方面。社会脑(social brain)对来自微生物群落的信号特别敏感。”他和其他科学家共同提出了脑肠轴的概念,在这个轴中,肠道微生物产生影响大脑功能的生物活性化合物。
(编者注:社会脑被定义为一个复杂的区域网络,它使我们能够识别他人并评估他们的意图、欲望和信仰等精神状态、感受、持久的性情和行为。)
其他研究也支持了这一理论,发现当肠道细菌帮助消化食物的时候,它们会产生大量的副产品,从而影响思想和行为。
例如,梭菌属细菌能在肠道中产生丙酸——一种短链脂肪酸,已知会破坏神经递质的产生。丙酸还会导致大鼠出现类似自闭症的症状,如有限的兴趣、不寻常的运动和不典型的社交行为2。
(编者注:自闭症在临床上有 3 大典型症状:社交交往障碍、言语发育障碍、兴趣范围狭窄和笨拙的行为)
有益肠道细菌的缺失也可能会影响社会脑的功能。2017 年,Cryan 报道称,当患有自闭症的小鼠肠道内的双歧杆菌属和劳特式菌属的数量较少时,肠道产生的色氨酸和胆汁酸偏少,而这两种化合物是产生 5 -羟色胺所必需的3。
在自闭症儿童的肠道菌中,韦荣氏球菌科、粪球菌属和普雷沃菌属的含量低于正常儿童4。研究人员还观察到,一些自闭症患者可能具有异常的血脑屏障,他们的屏障具有更多孔,从而使得一些有毒的细菌副产物能够通过血液到达大脑5。

这些发现促使帕萨迪纳市加州理工学院的研究人员将自闭症患者体内的微生物移植到了老鼠体内。
微生物学家 Sarkis Mazmanian 和他的同事给无菌小鼠移植了自闭症患者的肠道微生物。在六周大的时候,这些小鼠的后代与那些没有进行肠道微生物移植的小鼠后代相比,社会化程度更低,发出的声音更少,并且会进行更多的重复行为6。
这两组小鼠在生物学层面上的差异也是惊人的。该研究的共同作者 Gil Sharon 表示:“我们发现了粪便和血清代谢物的几个不同之处。”接受 ASD 供体肠道微生物的小鼠,其肠道细菌产生的化合物水平较低,而这些化合物被认为会影响大脑功能。
其中,特别关注到氨基酸 5-氨基缬草酸(5AV)和牛磺酸的减少。这两种代谢物都是 GABA 激动剂,能够增加大脑的 GABA 受体活性。GABA 是一种参与感觉处理和运动控制的神经递质,目前已经发现患有自闭症的儿童的 GABA 系统存在异常。
当研究小组给有类似自闭症症状的老鼠投喂这两种缺失的代谢物,Sharon 说:“它们的社会交往和重复行为的缺陷得到改善。”不过,该研究在数据分析和样本量上受到了一些质疑。
该研究称获得 ASD 患者肠道微生物的小鼠发声较少,但有人评论认为,自闭症涉及的肠道菌群来源只有 5 个 ASD 捐赠者和 3 个正常捐赠者。另外,研究人员就这些数据做了很多的分析以挖掘两组小鼠之间的差别,但是越多的分析在这个数据集上进行,就越有可能是一个错误效应。
对于这些质疑,研究团队拒绝发表评论并坚持他们的研究成果。
肠道微生物在社会脑功能方面的作用越来越受到关注,这让亚利桑那州立大学的研究小组加大了对自闭症儿童肠道微生物的测试力度。
微生物生态学家 Rosa Krajmalnik-Brown 和她的同事招募了 18 名患有 ASD 的儿童,年龄在 7 岁到 17 岁之间,其中包括 Ethan Loyola。和 Ethan 一样,18 名儿童均患有肠胃病史,包括慢性腹泻、疼痛和便秘。
研究中的儿童服用了 2 周的万古霉素来清除现存的细菌。然后他们每个人都从健康的捐赠者那接受了高剂量的肠道微生物——一些孩子接受灌肠,一些孩子则喝了促进细菌生长的饮料。
在 7 到 8 周的时间里,孩子们每天都要摄入一定剂量的微生物,比如 Ethan 就会用他的小玻璃杯喝着混合红莓汁的饮料,同时还要服用一种抗酸剂来中和胃酸,以提高新微生物的存活几率。
经过 18 周后研究结束,儿童的胃肠道症状发生频率减少了 80%。在研究后的最初 2 年内,大部分改善仍然保持。到 2 年的时候,孩子们在一项测试中的分数比试验开始时平均下降了 47%。
在为期 2 年的随访中,这些儿童肠道菌群的多样性增加,肠道菌群的数量增加,而这些增加的细菌如双歧杆菌属和普雷沃菌属,在患有自闭症的儿童中通常数量较少。Krajmalick-Brown 说,这表明长期的治疗已经成功改变了这些儿童的微生物群落。
小肠表面有称为绒毛的突起。
图片来源:Stephanie Schuller/SPL
尽管这些早期的结果看起来很有希望,但是作者强调,在他们完成包括对照组在内的更大规模的试验之前,很少有人下最终的结论。
Krajmalick-Brown 说:“我们的研究结果令人振奋,但这并不意味着每个人都适用。”目前,她的团队正在对 84 名患有自闭症的成年人进行第 2 阶段的微生物菌群转移治疗试验,其中有一部分人会接受安慰剂。
该小组还在寻找资金,以便在儿童中开展类似的试验。不过,即使这些试验成功了,更大规模的III期临床试验也需要几年的时间才能投入临床使用。在这个探索的过程中,Krajmalick-Brown 的团队希望能够找出症状改善后的生物学机制。
目前,还没有被批准的专门用于治疗自闭症核心症状(交流障碍、社会挑战和重复行为)的药物。Krajmalick-Brown 希望她的研究能带来新的治疗方式,但是不能保证一定能提供新的治疗方式。
虽然研究发现患有自闭症的人的肠道细菌特征与没有自闭症的人不同,但是还没有研究能够证明肠道菌群会导致自闭症。
一种主流的猜测是,一些微生物可能会导致那些有自闭症倾向的人自闭症症状更加严重,但是这一点也没有得到证实。患有自闭症的人的肠道微生物可能与正常不同,因为他们往往有非常具体的饮食偏好。
同样,肠道微生物疗法可以帮助 ASD 患者的证据也是混乱的。Krajmalick-Brown 提出了一个乐观的观点,但是一篇总结了 4 项其他研究的综述并没有得出补充肠道菌群对 ASD 患者有益处的明确结论。尽管这些早期的研究使用的是普通益生菌,而不是从人体肠道内提取的细菌7。
Cryan 说:“人类的数据非常复杂。如果我们的目标是微生物,那么是否产生行为效应会变得很有趣,但我们需要更多的证据。”
随着 Krajmalick-Brwon 的试验的开展,她警告儿童和家庭不要私自做粪便移植。相反,她说他们应该和医生讨论改变肠道微生物平衡的方法,比如使用传统的益生菌。她还想降低人们对治疗的期望值。“这可能有助于缓解症状,但我不相信这就是解药。”她表示。
但是,对 Ethan 来说,亚利桑那州立大学的研究是一个惊人的转变。在进行微生物转移后,他的腹泻和痉挛在几个月内消失了。但最引人注目的是他对人的新兴趣,他开始带着微笑醒来,并大声说:“Good morning!”
他也开始问一些问题,比如“为什么天是蓝的,云是白的?”。他的家人表示,这是 Ethan 以前从未做过的事情。在社交技能测试中,现年 12 岁的 Ethan 得分与非自闭症儿童的得分相同。
Ethan 取得的这些改善是因为他的胃痛消失了吗?还是这些新引进的微生物真的改变了他大脑的工作方式?没有人知道答案。但是 Ethan 的家人对这项研究表示欢迎,他的母亲说:“这项研究是一个转折点。这完全改变了生活。”
对于未来,Cryan 认为,对科学家来说,继续破解连接肠道和大脑的生物通路是至关重要的。
Cryan 说:“我们很乐观,但是我们需要数据证明一个健康的肠道意味着一个健康的大脑。”这些数据应该有助于确定是什么缓解了 Ethan 的症状,以及其他成千上万的孩子是否可以效仿。
本部分参考文献:
(滑动下方文字查看)
1.Desbonnet, L. et al. Mol. Psychiatry 19,146–148 (2014)
2.MacFabe, D. F. et al. Microb. Ecol.Health Dis. 23, 19260 (2012)
3.Golubeva, A. V. et al. EBioMedicine 24,166–178 (2017)
4.Kang, D.-W. et al. PLoS ONE 8,e68322 (2013)
5.Fiorentino, M. et al. Mol. Autism 7,49 (2016)
6.Sharon, G. et al. Cell 177,1600–1618 (2019)
7.Srinivasjois, R. et al. Arch. Dis. Child. 100,505–506 (2015)
第一部分:微生物抗癌
原文链接:https://www.nature.com/articles/d41586-020-00199-x
作者|Elie Dolgin
编译|Richard
第二部分:细菌药片能治疗自身免疫性疾病吗
原文链接:https://www.nature.com/articles/d41586-020-00197-z
作者|Eric Bender
编译|赵婧
第三部分:肠道菌群与自闭症相关吗
原文链接:https://www.nature.com/articles/d41586-020-00198-y
作者|Elizabeth Svoboda
编译|617


