
我给大家介绍一下关于菌群研究中的一些方法学,我们的一些心得和体会。我叫丁旭,是上海微基生物的创始人。

刚才各位老师从测序仪器的发明和应用,介绍到技术,包括生信技术、组学技术。我可能和大家的背景相对来说差异比较大。因为我既不是做测序出身的,也不是做生物信息学出身的。
我可能经历比较复杂,我本科是生物化学与分子生物学系的。然后2002年到2007年做模式动物研究,是在复旦大学发育生物学研究所,当时我们是运用各种模式动物去研究人类的疾病,(各类研究实验)“玩”的很开心。当时我们所算是国家重点支持的一个实验室,累计拿过上亿经费的国家资助,做过转基因线虫、转基因果蝇、基因敲除的小鼠,各种细胞学实验。
我们所2005年时曾经发过一篇《Cell》的封面,是第一个在哺乳动物当中,大规模地用转座子去进行基因突变筛选。
所以当时我们实验室顶峰的时候,曾经有两三百个实验员,天天做什么呢?那时候没有高通量测序技术,就是做Inverse PCR,非常苦的一件事情。然后有20多个研究生等着筛出来突变在哪里,在遗传背景上搞清楚,然后后面做一堆的生理生化切片、免疫方面的检查,就是跟小鼠找毛病。
国家当时投资上亿,我们养到了10万只小鼠。就这么几年的时间,实验室真的是给吃穷了。我现在想,如果那个时候有高通量测序技术,我们那时候应该可以发很多的文章。
当时我运气还比较好,因为我可能是国内最早一批做基因打靶小鼠的,然后我的那个小鼠有毛病了,我开心了,做了一个不育不孕的小鼠疾病模型。
当时就感触很深,我们这些做科研的人,做了几年就发了篇paper,然后很多年以后被人引用了很多次,但是并没有一个实际的产业转化。所以说当时我有一个心愿,我一定要用生物技术去做更多有应用价值的事情,然后我就跳到商业市场当中来。
那个时候去面试过ABI的技术支持,当时觉得我要做市场,你给我做技术,我不要再做。后来去哪里了呢?去了Novoprotein,这是复旦大学生创业的创业团队,这个公司到现在已经15年了,已经做到好几百号人了,主要做细胞因子,做酶制剂。我当时的任务就是把他们开发出来的各种各样的原料做成分子试剂盒,给一些诊断试剂公司供应。
做了四五年以后,我觉得还是想玩点更加靠近应用的行业。
我非常认真的去考察,发现高通量测序在微生物研究领域一定是一个大有应用市场的方向。那时候高通量测序刚刚出来没有多长时间,2011年左右,才刚刚开始应用在微生物组上面。当时我觉得我选的这个方向是一个有前景的细分方向。结果没想到,到目前来说竞争非常激烈。但是行业的蓬勃发展,也确实让我们看到了,高通量测序解决很多以前不能解决的问题。
可能我的个人特点是,我要专注,我要做一个细分领域。我个人的判断是,生物行业的这种研究,它一定是个长尾的,每一个细分领域,都会有一个很快速的发展。你只有坚持在某一个细分领域里面沉下来,把你的这个技术打磨的很好,那么你就可以在这个领域里面去做到极致,成为一个行业的佼佼者。所以说我们就是专注做微生态的研究服务,来磨砺我们的团队。在这个过程当中试图去寻找一些商业转化的应用。
总结过去的十年,我的想法其实没怎么变过,就是打算用商业的方式去践行生物技术的应用和转化。
这几天的会议,可能大家对微生态研究的各种故事、各种方法、各种应用成果可能会听得很多。我主要就我们在实验设计和方法学上的一些细节给大家一些分享和提示。
我们知道,微生态的研究非常热,我们去总结下这个套路。其实很多时候微生态的研究都在干什么呢?就是找差异,不管是找不同人群的差异,还是干预前后的差异。最后,通过各种的方法做到一个机理性的研究。
要做机理性研究,那么你肯定要做动物实验,或者做细胞学的实验,或者一些菌株拿到以后做一些生化生理的实验。你有一个核心的问题,你能不能分离到这个菌。
我们大概在四年以前就认为,菌株的筛选和发现一定是一个热点。我当时找过市场上所有的服务公司,没有一家公司提供厌氧菌的分离,也很少有公司提供需氧菌的分离。
可能当时很多人不太去研究这个事情,需求还没到。高通量测序刚出来,大家可能还忙着找差异发文章,还没有想过再往前更深一步去做。我们四年以前就开始做这个事情,但是也就是最近两年才慢慢的开始有不少老师来找我们做分菌。

我想讲一讲我们分菌的策略,跟传统的挑菌是不太一样的。它是一个靶向的分离,基于高通量测序的序列来指导进行分离。
首先,我们在做实验的时候,常规的微生态实验,我们找不同的队列,找到差异,锁定你需要的这个OTU,或者是某一个菌。这个菌,你可以不知道它是什么。常常有老师会问我们说,为什么你给我出的这个报告里面,这么多菌在spieces的水平上是鉴定不出来的。
其实这不是一个坏事。他常常觉得我这个文章不好写,我经常跟他讲,如果这个关键菌你鉴定不出来,这是一个好事啊,证明这个菌以前可能被人研究比较少,你如果能把它分离出来、鉴定出来,深入的去研究,那这是大有故事可以挖的。
首先一定是要做多种培养基的培养及培养后的测序。好处是什么呢,就是文献上的已经发表的培养基的配方没有上万种,至少也有几千种。你可能会针对你感兴趣的那个菌去查一查,看看它适合用哪种培养基来做。有文献曾经用过六七十种培养基,号称是可以培养出来90%以上的肠道菌群,它相当于是一个培养组学的一个方法来做。最重要的目标是什么呢?是筛选目标菌群最佳培养条件。
分离的一个基础肯定是要能够把它培养出来,然后基于测序的结果和培养基筛选出来的优化条件,再去扩大培养,去挑进行下一步96深孔板的分选。挑到这个板里面以后,再去测序。
每一个菌要把它培养成菌液,把它DNA提取出来。我们也曾经试过,用煮沸的方法,用液氮,加上煮沸,然后丢进液氮中去。有的菌是很难裂解的,不管你怎么折腾都提取不了。
你一定要用很好的商业化试剂盒把全部细菌提出来以后,才能很好地可以进行下一步测序的。而且还有个通量的问题,就是你怎么样能够大批的上千上万的平行地进行菌的提取和建库,这其实就是需要商业化、自动化的产品来解决规模化生产的问题,同时也能降低成本,性价比高。
提取以后,接下来事情就比较好办了。就是你首先拿到初筛的菌,后面再进行多次的分离纯化。我提醒一下大家,我们在实践当中碰到很多次,老师一开始的时候样本采好了,但是他是用的常温保存液来保存。我尽量给他们讲,常温保存液就是把菌做成木乃伊。他最后说,这个病人或者某一个个体当中有一种菌,他特别感兴趣,想拿到这个菌。但是再去把那个病人找回来,再测序的时候,发现那个菌已经消失了,在那个人的肠道中找不到了。所以说这种事情提醒我们,样本采集非常关键。你在前期的时候,要同时做好你需要的样本。如果你要做代谢组,那么你的样本保存还得再多几份。活菌它是需要厌氧保存的,我们做了一些厌氧保存液来保持它的活性。

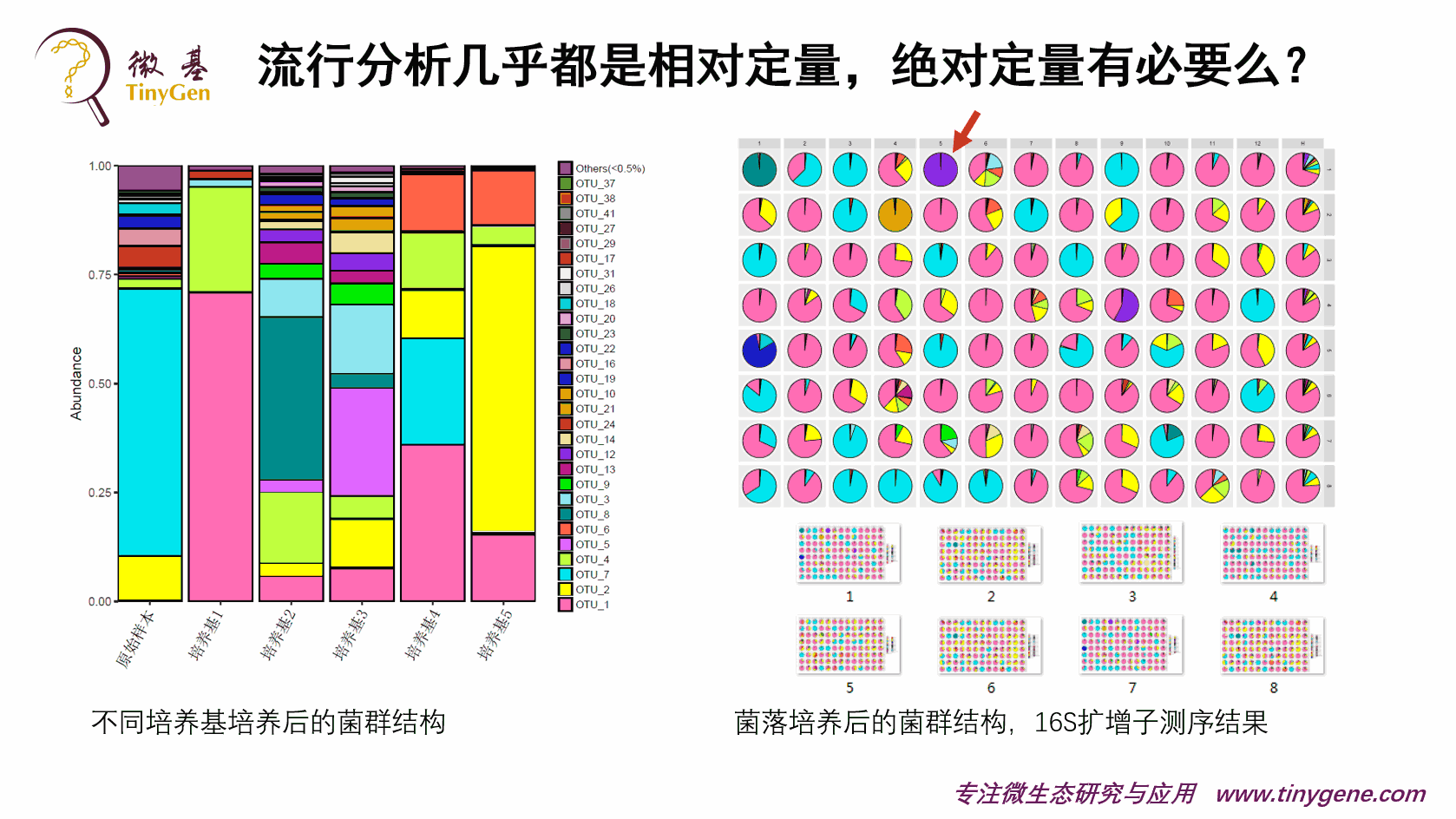
这个是我们结果的一个展示。
上面的这个图的左边是不同的培养基筛选出来的一个情况。大家可以看到,虽然说是同一个样本,在不同的培养基出来以后,它的菌群结构是差异比较大的。但是我们一般在做的时候,都会有针对性去筛选,尽量能够把目标菌群富集到1%以上,不然的话,后面挑克隆的工作量会非常大。
接下来我们用深孔板,正常情况下都可能会上千上千的去做,然后每一个深孔板通过DNA提取以后,批量去建库,保证每一个孔能够测出来,这个是比较好的情况。
我们在做的过程中发现一个什么情况呢?就是你不管再怎么仔细地去挑这个单克隆,初筛出来的这个菌株,大部分都是个混合物。哪怕是它的菌株看上去丰度100%都是某一种菌,实际上你在后面扩大培养的时候,会发现它其实是个混合物。
我们后来想过这个原因,为什么呢?因为这些菌可能常常是一个共生的。一开始的时候,某一种菌可能比较适应某一种培养基的环境,长起来以后,在平板上原来休眠的一些菌,虽然不生长,但是它可能在那里潜伏下来。然后呢,它会随着这个菌一起长大,这个时候你去挑这个孔,常常就是一个混合物。
接下来,我想提醒一下,我们刚才看的这个报告当中,很多的分析都是相对定量的。就是说我抽了10万条序列出来,来看它的这个样本当中某一种基因或者某一种微生物OTU的相对丰度是多少。这个有点像做人口普查,在北京抽样,和在江苏的比如说嘉善、嘉兴去抽取样本,有可能人群的结构看上去是非常相似的,但是这两个地方的影响力是完全不同的。为什么?大家忽略一个绝对定量,就是说每一克样本当中,每一种微生物的数量是多少?这个其实是容易忽略的。

绝对定量在研究中重不重要?我们过去传统的这种方法都是用相对定量来分析。
我这有一个引子。2017年的时候,我当时看到上面这篇文章,既高兴又后悔。它一共只做了130多个样本,然后16s高通量测序,再加上qPCR和流式细胞术。大家看一下这么简单的,或者说花费比较少的文章,最后发在什么上面?
它之后发在《Nature》上面,两页纸写得非常漂亮的报告。我建议做研究的老师可以去看一下这个文章,它里面有很多值得我们去借鉴的点。它的创新点在哪里呢?它其实就是把这三个老技术结合起来,做了一个绝对定量的分析。
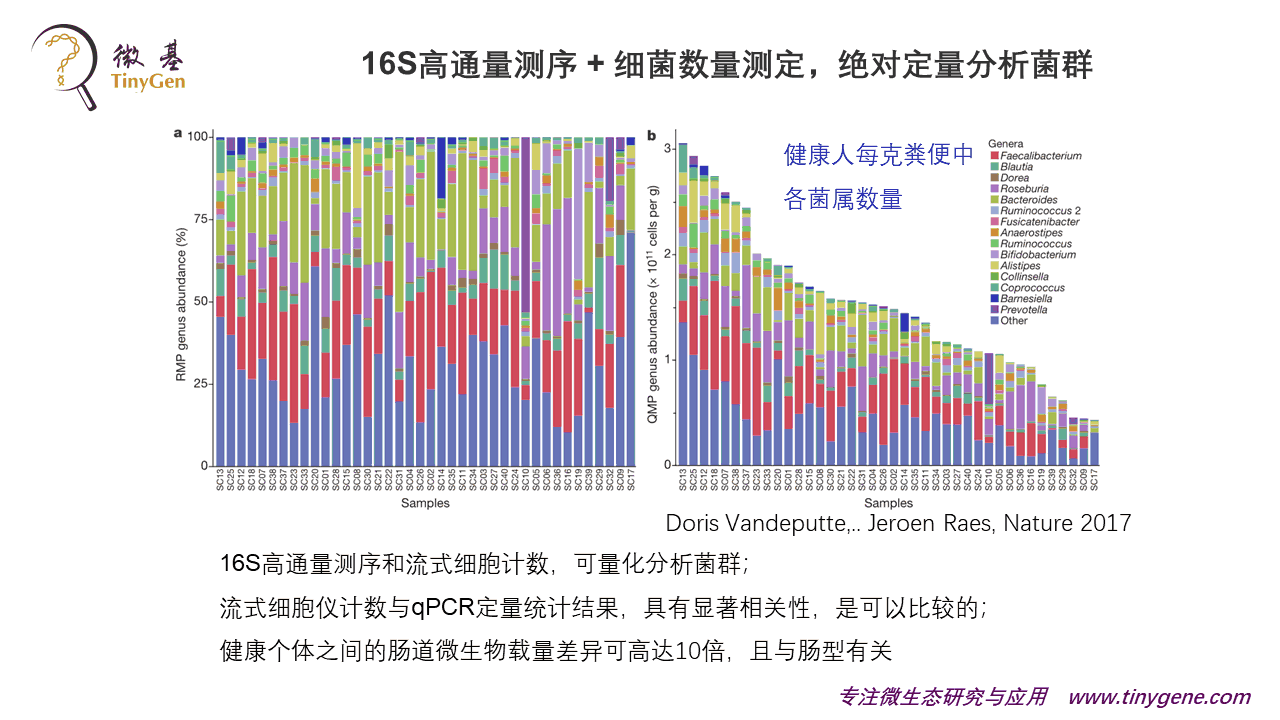
看上面这张图,左边它是一个相对丰度的,是我们常见的情况,右边就是我说的那篇文章,一个绝对定量的研究。
他们这个工作就是新鲜粪便采集以后去做了冻干,冻干成一个干粉,这个湿的粪便跟冻干的粪便偏差大概有百分之十几,其实很少,远远低于一个数量级的情况。他做了40个健康人,发现健康人的每一克粪便当中,菌群数量变化有十倍的差异。他同时做了流式细胞和qPCR的比较,这两者数据是强相关的,都可以用。
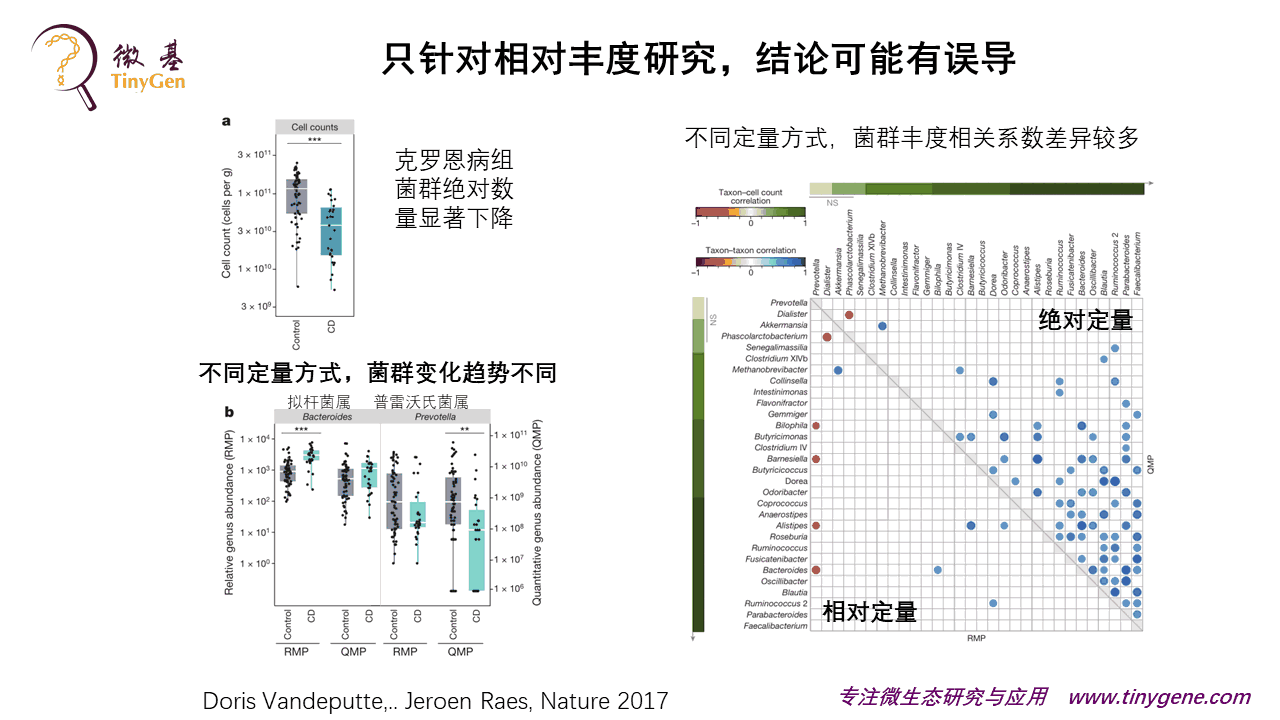
然后,他们找了40个克罗恩病患者和40个健康人,去做两者之间的差异。他用绝对定量的方式发现克罗恩病患者的菌的数量是下降的。
不同的定量方式,你会发现比如拟杆菌,相对定量的情况下,两者有显著性差异;但是在绝对定量里面,它是没有显著性差异的。你做菌和菌之间的丰度相关性分析,会发现绝对定量和相对定量是完全不同的一个结果。
所以说这篇文章可以给大家一个警示,如果我们做菌群研究,只盯着一个相对丰度去看,就像他们说的,抛开剂量谈疗效,这个是耍流氓,或者至少说我们可能会漏掉很多相关的重要的信息。

跟大家说这篇文章,就是它用的所有方法,16s测序、扩增子测序,相对来说已经很普及了。qPCR、流式细胞,这些都已经十几二十年的老技术。你用老技术去把它组合起来,去阐述一个老问题,但是你是从不同的角度去描述的,那么一样可以做出花样来。
然后我当时为什么会很后悔呢?因为我们在四、五年以前跟客户去讲的时候,就建议说你同时做一下绝对定量。我们做提取的时候,每一个样本的定量都有记录的,因为怕他后面要做qPCR定量来补这个实验,那我们这个数据随时可以拿出来。所以说错失了一个机会,当然别人的想法非常的好,写成的文章也很漂亮。

接下来我想说一下几种定量方法。常见的像qPCR和流式细胞这两者情况是有点差异的。
qPCR方法大家说定量很准确,但是我们做下来,其实可能它的精度还是稍微有波动的,波动可能在百分之几十。不同批次去做,它们还是有一点差异。最好的情况,就是你能够多做几次重复,然后进行测量,那么它会准确一些。
另外就是qPCR方法受基因组的干扰很厉害。因为我们一般是用标准品去比。但是qPCR方法,我们做的样本里面有很多基因组的杂质,这个时候会显著影响定量的结果。
内标法其实是一个很老的方法,但是高通量测序出来以后,是可以把每一个测序的条数去数出来的,所以说这个老方法又是热起来了。我加一个人工的序列,加入引物序列,同时进行扩增。可以数加进去的内标序列多少条,测出来如果它占10%,那么你的目标序列就应该是90%,那么你的数量就可以定出来。
流式细胞术有一个问题,就是它只能计量细菌的细胞数,不是16s 的拷贝数。你要转化成16s拷贝数还需要有一个数据库,要求这个数据库中每一种菌的16s拷贝数的份数是切确的,目前数据库还缺少很多种菌的信息。
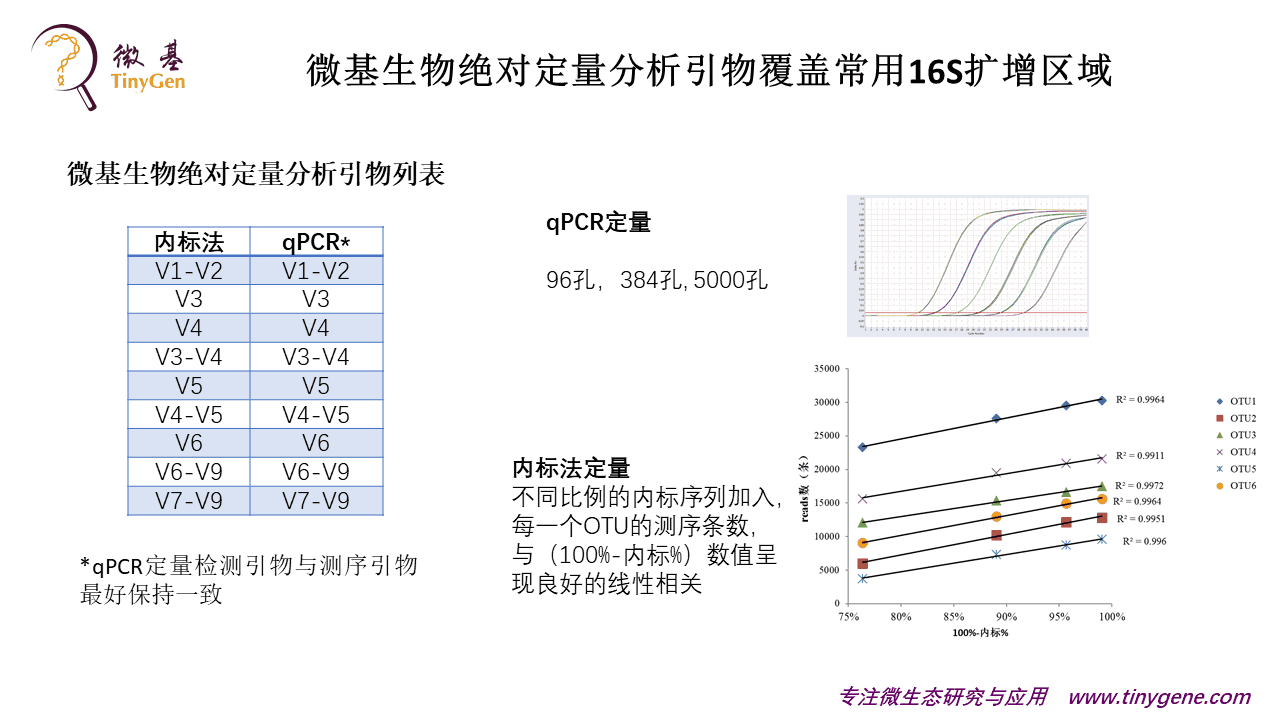
我个人觉得说qPCR和内标法,这两者可以配合起来用。内标法和qPCR的方法,它所有对应的人工做的定量标准品和qPCR的引物测试我们都做过。
大家可以看到内标法有个坏处,就是一个样本加进去的量你不知道它有多少,你只能估计,就可能有一个几倍或者甚至更高的一个偏差。大家可以看到这张图,我加进去的这个内标的丰度从百分之几到百分之几十,它其实线性关系还是蛮好的。所以说这个方法,缺点是比较浪费测序成本。
qPCR方法是一个比较传统的方法,现在我们从96孔一直到高达5000孔都有平台可以用。
接下来,我又有一个引子。
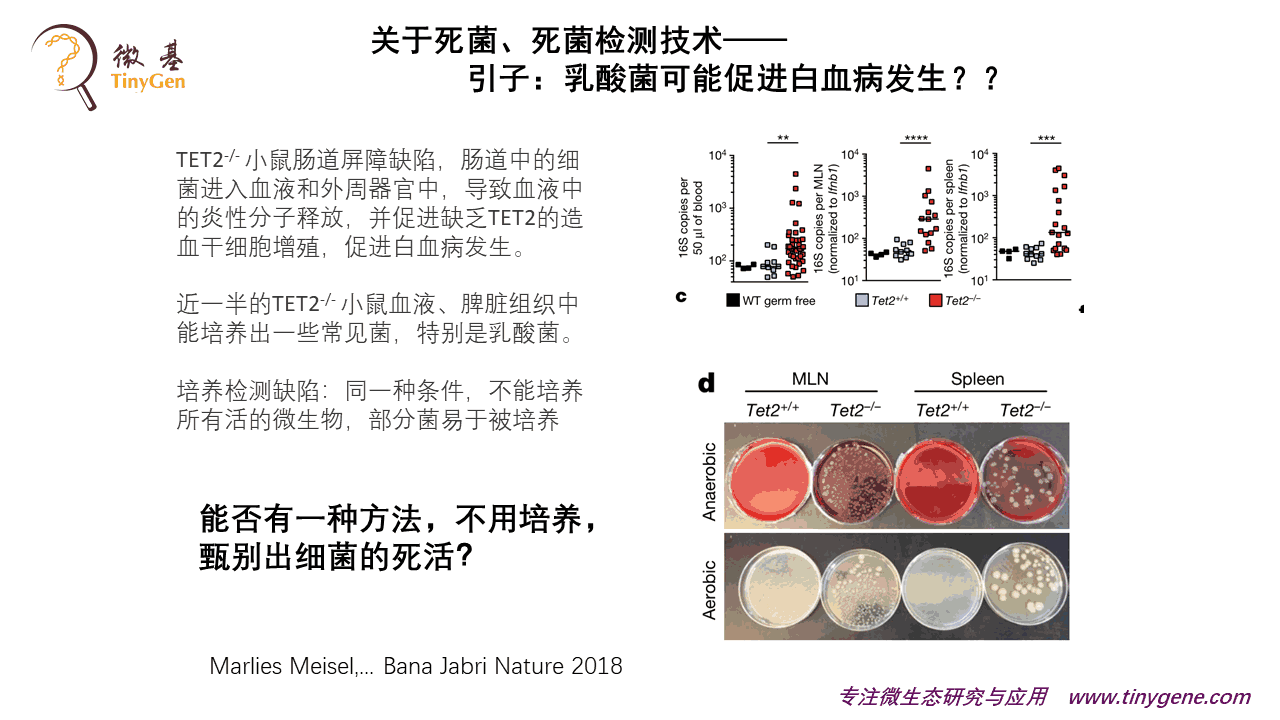
去年年中有一个文章,说乳酸菌可能会引起白血病的发生,非常耸人听闻的一个消息。
乳酸菌大家都知道,是非常知名的一个益生菌。他那个文章讲某一种缺陷型小鼠容易发生白血病。他把容易发生白血病的小鼠拿来做分析,发现它的血液和组织当中,细菌的数量显著上升。然后他拿去做了培养,可以培养出来很多活菌,里面有一大半都是乳酸菌,所以他得到这么一个结论。
但是这个实验是有一个缺陷的。真正是乳酸菌在里面起作用吗?还是说活菌其实有很多种,只是乳酸菌在这种培养基上比较容易被培养出来?因为我们知道大肠杆菌在做厌氧培养的时候,可能长出来很多都是大肠杆菌,但是它在真实的肠道菌群当中的丰度只占可能百分之零点几。
所以说有没有一种分子学的方法,可以甄别出来一个死活菌的一个情况。答案是老早就有。
实际上在食品检验行业就有。因为食品检验常常要在现场做,比如说要检某一个食品当中活菌的存在,它需要有一个甄别死活菌的判断。
比如面包是需要发酵的,它的发酵是产生微大量生物的。但如果是死菌的话,它对人体基本上会认为比较安全,但是说如果有大量活菌,那你吃下去可能会拉肚子。
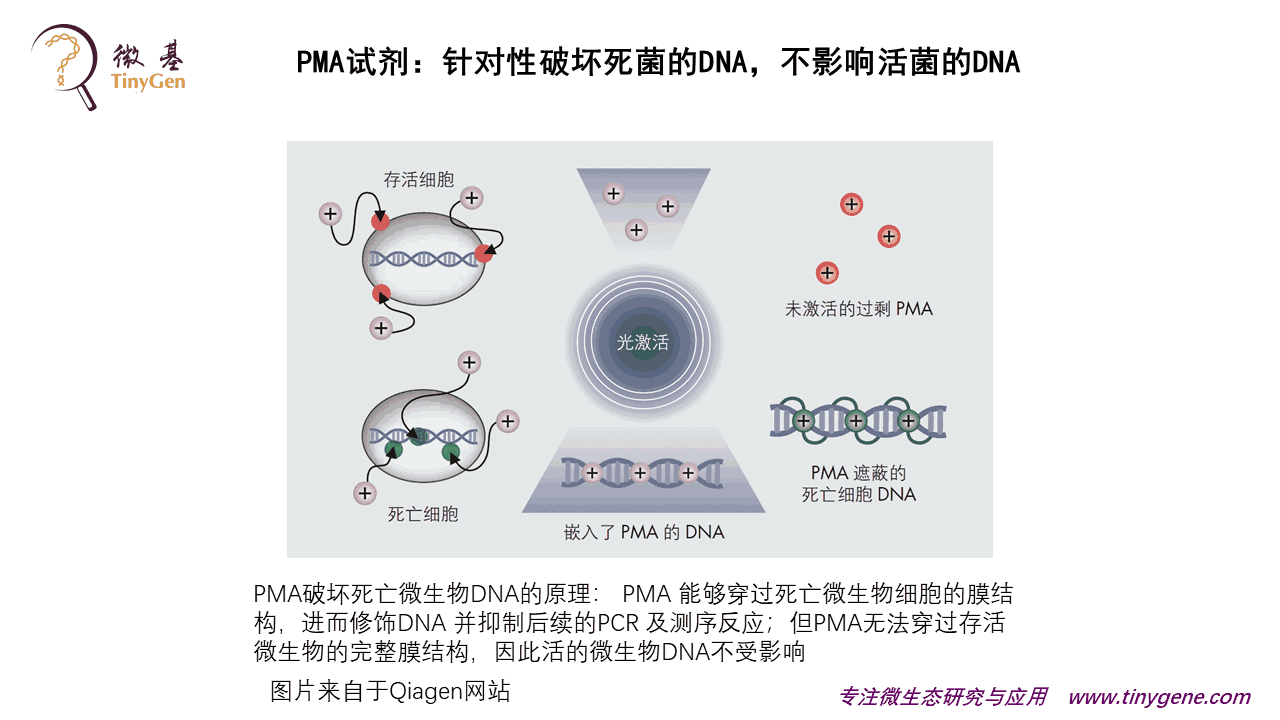
这个检验就是用的PMA试剂。原理很简单,PMA 能够穿过死菌细胞的细胞膜,进而修饰DNA,这样你后续既不能做PCR,也不能做高通量测序了;但PMA无法穿过活菌的完整膜结构,因此活菌的DNA不受影响。
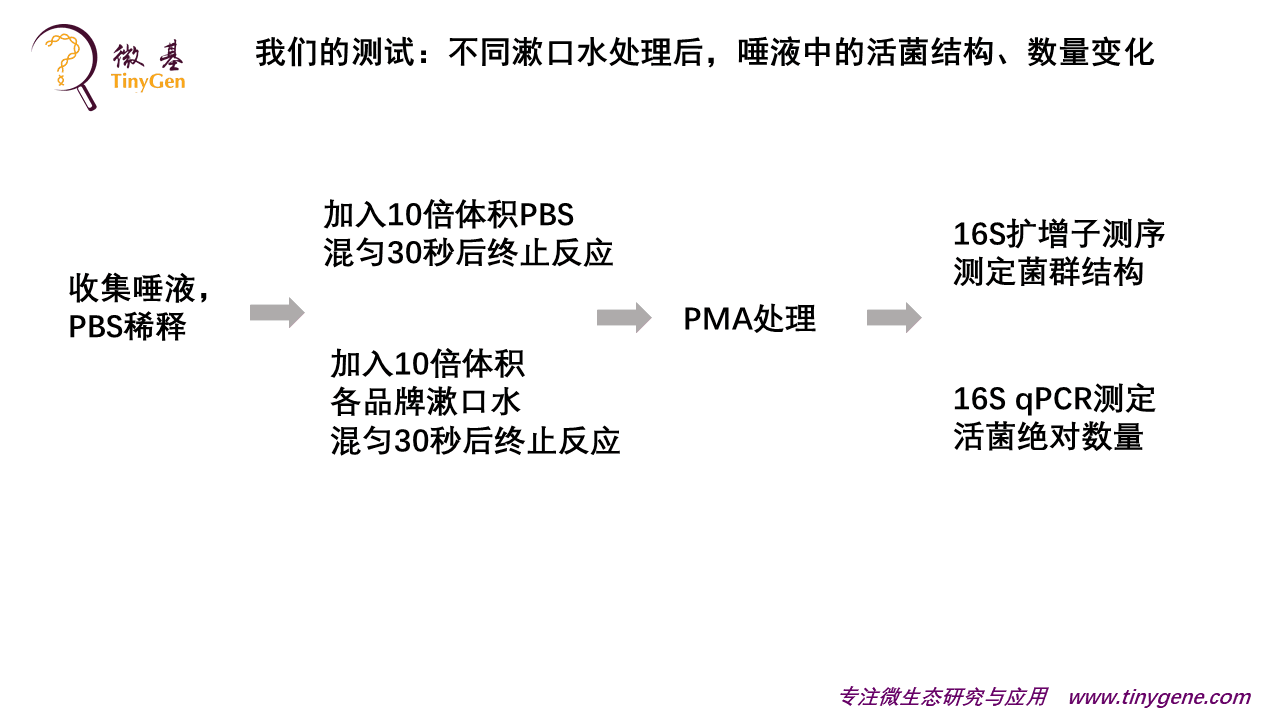
我们大概是两三年以前做的这个技术。我们的数据很多都是客户的数据,不方便分享,所以在参加中国肠道大会之前,我们自己特意做了一个大家感兴趣的,跟大家关系比较密切的试验:不同漱口水对口腔微生物影响。
市场上有不同的漱口水,我们很想知道,不同的漱口水处理以后,还有什么样的活菌可以留下来。因为我们知道,菌死以后它尸体还在,你去做二代测序,检测到的结果是不会变化的,因为活的死的都能测出。那我们用PMA去来处理,来了解处理后的差异。
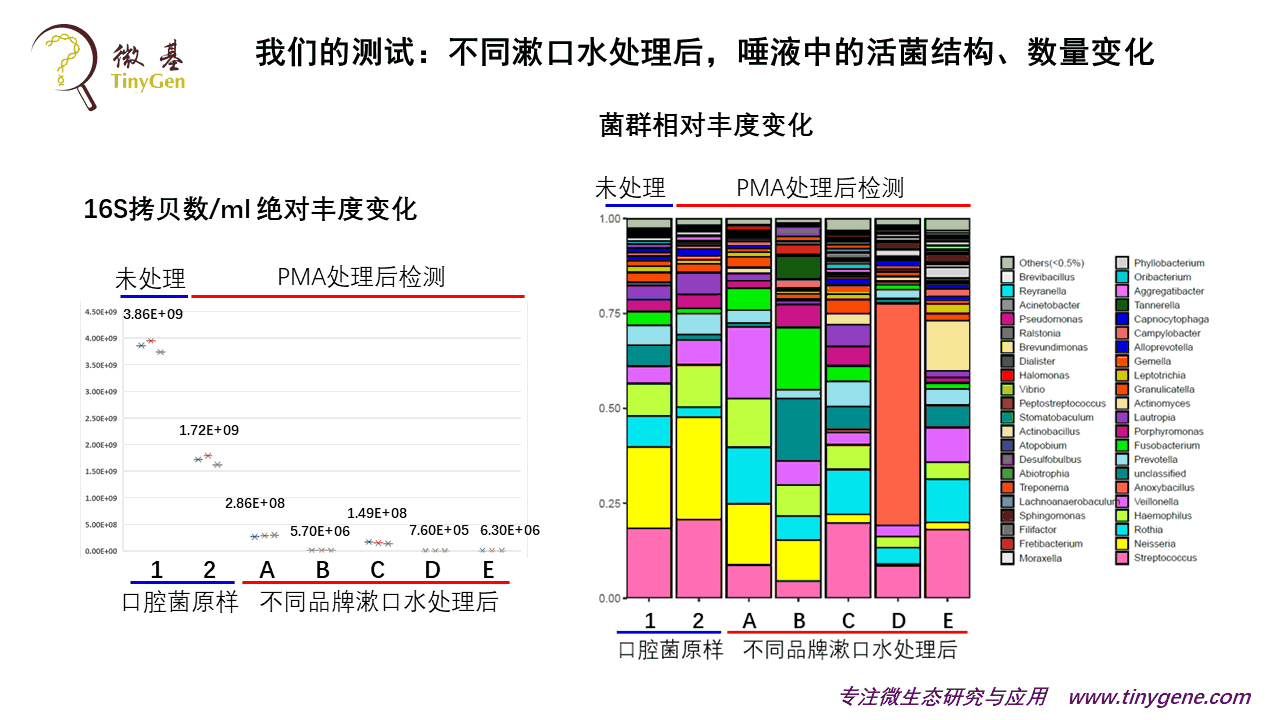
上面就是我们的试验结果。这个相当于是我们自己的兴趣型实验。主要是告诉大家,漱口水确实可以显著杀菌,但是杀灭种类有偏好。
看上面这个没有用漱口水处理的细菌数,活菌占总的口腔菌群大约是百分之四五十左右。用这个漱口水处理以后,它可以大大的杀掉口腔里面的活菌。
5个不同品牌做下来,差异也很大。差一点的,可能是杀到百分之十左右,好一点的,可能能到万分之一。
但是大家知道,如果有不同菌种活下来了,口腔的微生态肯定会受影响。那么我们很关心它的菌群结构是什么样子的。
那我们把DNA样本,去扩增建库,进行高通量测序。大家可以从上面图上看到,不同品牌的漱口水使用之后,残留活下来的微生物差异很大的。
这可以提示我们,比如像牙膏,经常换用不同的牙膏,可能会杀菌效果更好。如果你有使用漱口水的习惯,可能你换一换不同的牌子,会杀掉不同的菌。当然,这个杀菌,它到底好还是不好,那么我觉得可能要结合后面的测序,哪些菌活下来,是更有益健康的,就值得去选购,也许可以用来做精准的漱口水的推荐。这个给大家介绍我们的一个兴趣型试验。

我们做的很多准备工作都是顺理成章的,大家去做的时候就会想到。很多时候听起来很简单的事情,在做的过程当中,其实会存在很大的问题,就是现场采集样品,需要一个比较合理的采集条件,减少你的误差。比如说如果把这个菌采完以后直接冻在-20℃,那我可以告诉你,冻存后的菌再做PMA检测,出来的结果全是死菌没有活菌。为什么呢?因为你的这个样本直接再冻融的过程当中壁破掉了。
从原理上来讲的话,它的膜的完整性不受保护,你再去做处理的话,就会有问题,假阴性会很多。
所以说你的保存条件需要保证实验的严谨性。但是还要兼顾实验的方便性,样本采集的方便性,这个是一个最大的问题。
过去的两年因为有人有需要,我们就去做了这方面的开发,可以做血液、尿液、唾液的样本种活菌的保存,方便性和严谨性兼顾。

我想提醒的是,如果在做NGS检测的时候,在bench work(分子实验)上,我们在前期的时候可能要多考虑一下,特别是像这种痕量微生物样本的检测。
我们之前跟一家医院做检测的时候,他们的棉签上我们测过,上面的背景微生物DNA是很高的。这个时候用这个棉签去取样,它的强背景信号对弱的信号干扰是我们需要去考量的。
我还想讲一点,我们今天听了不同的测序平台、测序技术的介绍,有最长的,有测量最大的,性价比最高的。其实这些武器,我个人认为每一个测序仪都有它自身的一个优点,我们老师在选择的时候需要去权衡你的这个实验的需求,然后针对性的去选择。
不是说哪种武器更先进,那么它就一定会完全占领这个市场。就像匕首,已经用了可能上万年,但是在今天这个热兵器时代,匕首还是一个必须的军备品。

最后是我们的广告。
我们目前专注在做微生态的检测上,我们对分子实验的技术会比较花心思地去打磨。我们也提供细菌的靶向培养分离,多组学的联合检测。
然后,我们很希望老师在实验之前能预先跟我们交流,我们这时候可能会有一些建议和帮助,能够避免老师少走一些以前别人犯过的设计上的一些坑。
我们去年下半年开始和商业公司进行合作提供标准化的检测服务,每个月可以做上万例的扩增子测序,去年已经大概做了几万例。我们一些特色服务,刚才已经讲过了。

好,最后谢谢大家聆听。


