随着《科学》杂志的发文,“FDA不再要求在药物临床试验前进行动物实验”一事最近引发众人关注。当动物实验不再成为强制性要求后,器官芯片等新技术将如何在临床试验前阶段发挥重要作用?器官芯片技术目前在胃肠道领域又已经发挥了那些作用?
今天,我们共同关注器官芯片技术。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
近日,《科学》杂志发文,FDA不再要求在药物临床试验前进行动物实验。

2022年9月,美国参议院无异议地一致通过了美国食品药品监督管理局现代化法案(FDA Modernization Act 2.0),该法案旨在取消联邦政府对新药和仿制药进行动物实验的强制要求,以在未来几年里大幅减少动物实验的使用。
2022年12月,美国众议员批准了该方案,并作为《综合拨款法案》的一部分,由拜登签署成为法律。该法案取代了1938年的规定——潜在药物必须在动物身上进行安全性和有效性测试,允许FDA在动物或非动物实验后,将药物或生物大分子(如抗体)推广到人体试验。
这一重大政策变化或将大大推动器官芯片、类器官等一系列新技术的发展。实际上,在过去的 10 年里,各种各样的器官芯片被研发、应用及推向商业化,使用器官芯片代替传统的细胞模型和动物模型进行药物吸收代谢、分子作用机制及疾病病因分析等相关研究也逐渐成为一种趋势1。
那么,什么是器官芯片呢?
器官芯片是一种模拟体内组织微环境的微流体细胞培养装置,之所以将其称为“芯片”,是因为其最初是采用计算机微芯片的方法制造的2,之后逐渐融合了其他研究领域的多项技术。完整的器官芯片系统主要包括微流控、干细胞培养、微电子技术及多种检测方法。
器官芯片作为一种微流控芯片,具有体积小、高通量的特点,这使得实验操作更加方便快捷。此外,其能够在细胞水平上模拟体内器官的多细胞层结构、组织与组织界面以及组织微环境,使得实验结果更精准明确3。同时,器官芯片的使用让实验过程变得可实时监测,相关产物的分离和分析也更加便利4。
微流控器官芯片最初只是将细胞放于常规刚性底物上,在单个流动通道内进行细胞培养,后来随着科技的发展,这些单独的微流控通道整合了不同类型细胞,形成“多生理系统”,并可以对肿瘤细胞侵袭等生理过程进行建模5,实现了从单细胞系模拟器官功能到多细胞模拟,从单器官到多器官集成的转变6-8。
那么,今天就让我们来了解一下器官芯片在肠道和菌群领域的发展吧。
在过去的十几年中,肠道器官体外模型不断迭代升级,从传统单种细胞培养到实现3D细胞培养,再到多细胞共培养形成类器官模拟肠屏障功能,如今已经发展到可利用微流控芯片技术模拟肠腔蠕动功能。
肠道器官芯片技术也随之迅速发展,2012年Ingber等人建立模拟人体组织微环境的大肠芯片9,后来Kim等人通过引入致病性大肠杆菌和人单核巨噬细胞构建肠炎病理模型,利用肠芯片研究宿主和微生物互作作用10,到现如今将原代细胞和类器官与大肠芯片相结合,实现肠炎相关药物筛选研究平台的构建11, 12。
肠芯片技术结构如图所示,其通常含有微流体装置,支持细胞培养、层流流动并控制微流体。此外,还带有注射器或蠕动泵,通过灌注培养基模拟在肠腔的蠕动13。
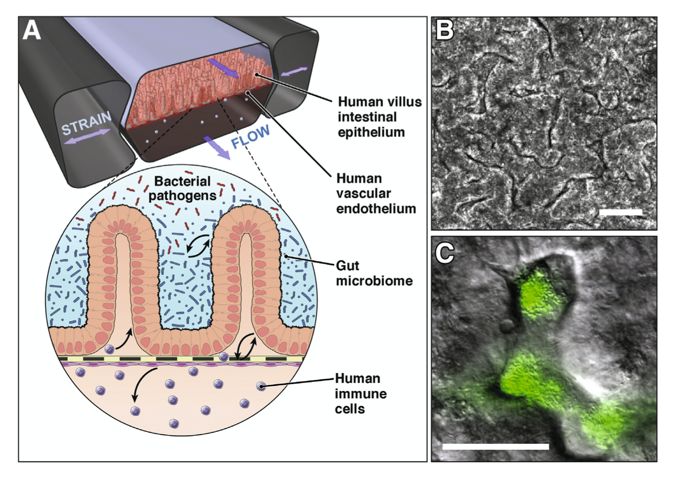
图. 肠芯片结构示意图13
随着肠道器官芯片研究的飞速发展,其应用也日渐广泛。Tovaglieri等人利用器官芯片鉴定调节肠道出血性大肠杆菌(EHEC)致病性的肠道菌群代谢物,为靶向菌群产物防治人类细菌感染奠定基础14;Liang等人则设计高精度流体控制和高表面积/体积比的肠芯片用于评估食品抗炎性15; 此外,通过创建包含微生物组和免疫细胞的个性化肠芯片11,研究人员能够在细胞、组织和器官水平上应用合成生物学方法进一步分析肠道及其他相关器官微环境内的分子生物学机制,加深对肠道相关生理和疾病机制的理解,并促进新疗法的开发。
肠道芯片在肠-脑-菌群(GBM)上也有所应用。GBM作为近年来的研究热点,被发现可以通过免疫、神经、内分泌等途径发生双向互作16,但肠道菌群与大脑之间的相互作用很难在动物模型上进行模拟,因为动物的生理系统与人类的生理系统存在巨大差别。
针对这个难题,麻省理工学院的研究人员利用器官芯片技术平台构建了一个多组织器官体外模拟系统,通过将肠、肝、脑、免疫等多个组织器官整合在一起,开发了可模拟肠脑轴的“多器官芯片”系统,实现针对了大脑、肝脏和结肠之间的相互作用的研究17。
研究人员首先将肠胃道和肝脏的微环境与脑组织进行连接,在培养过程中,加入CD4+ T细胞模拟帕金森(PD)患者的疾病模型。通过该模型,研究人员印证了肠道菌群相关的短链脂肪酸(SCFA)会促进PD患者病理相关基因的表达,并基于此,提出了可通过调节肠道菌群来预防或治疗这些难以攻克的大脑疾病。
上述结果充分说明了利用体外肠芯片模型及其病理模型可以为疾病药物研发筛选及机制研究提供可靠、便捷的研究平台。
当人体微生物组受到破坏时会引发诸多疾病,过去人们的研究焦点更多的还是集中在肠道微生物上,但近年来研究人员发现,女性阴道微生物组同样值得关注。
目前全球近30%的育龄妇女都患有细菌性阴道病(BV),它也是美国 15 至 44 岁女性中最常见的阴道感染疾病,影响了近2120 万人,每年用在BV上的治疗费用约48亿美元。虽然不会危及生命,但BV会导致不孕、早产和性传播疾病的易感性增加。
但阴道健康相关的研究很难在实验室环境中展开,部分原因是实验动物的微生物组与人类“完全不同”,为了解决这个问题,哈佛大学Wyss研究所使用活细胞和细菌来模仿人类阴道的微生物环境创造了“阴道芯片”18。
该芯片主要由人类阴道上皮和下面的结缔组织细胞组成,同时包含携带雌激素的流体材料来模拟阴道粘液,复制了阴道的许多生理特征,其可以接种不同的细菌菌株,帮助测试针对BV的药物,以研究药物对女性阴道健康的影响。
但研究人员也指出了其局限性,例如,由于BV与分娩并发症之间的联系,许多研究人员对怀孕期间发生的阴道微生物组变化感兴趣,虽然芯片的组织对雌激素有反应,但它尚不能在没有其他器官反馈回路的情况下完全模仿怀孕过程,因此未来阴道芯片还有较大的提升空间。

在过去的几十年里癌症仍然是造成世界各国人口死亡的主要原因之一。结直肠癌(CRC)作为世界三大常见癌症之一,确诊后5年内生存率为63%,然而在被诊断为转移性疾病的患者中生存率仅为10%左右19。目前,CRC的治疗方法包括化疗、放射治疗和手术,但这都伴随着高风险的并发症,且成功率不高,所以需要开发新的治疗策略。
然而,目前针对癌症治疗的研究和抗癌药物筛选大多是通过细胞模型和动物模型进行的。并且有研究表明CRC是由一系列基因改变组成的分子异构疾病,相比单一疾病类型其药物筛选难度大大增加20。
因此,为了兼顾高通量药物以及解决传统动物模型成本高、周期长、与人存在种属差异的问题和细胞模型无法模拟人体器官的微环境的问题21, 22,肿瘤器官芯片作为一种新的工具应运而生。
比如,有科研人员通过整合多个细胞元素开发了一种新型的肠道器官芯片23,将人肠道上皮细胞、营养物质和肠道微生物共培养控制产生SCFA的比率,从而限制小肠上皮细胞自我更新能力,以观察代谢产物的变化。该技术有助于研究必需营养素与致癌微生物生长之间的关系,可以极大地提高研究人员对癌症生物学的理解,加速药物研发的同时降低药物开发成本24。
随着器官芯片的蓬勃发展,其在疾病治疗、药物筛选与开发、精准医疗等方面都有所发展,器官芯片的应用价值也得到了社会各界的认可。
在2015 年,器官芯片技术已引起权威杂志 Nature 的注意和制药工业界的高度肯定。2016 年,世界达沃斯论坛将器官芯片列为“未来改变世界的十大技术”之一。根据器官芯片的发展速度以及器官芯片公司扩大生产的能力,预计2026年将达到21亿美元1。
然而目前许多文献报道的器官芯片的相关研究还停留在对某种疾病模型的模拟和对药物效果的评价,尚未达到在药物筛选中替代动物实验或早期临床试验的目标要求25。此外目前的器官芯片系统大多只能在单个芯片上构建一种实验的单元,离实现大规模、高通量的筛选和分析也有一定的距离。
随着微流控技术、细胞生物学技术和组织工程技术的进一步发展,期待未来能够尽快在芯片上构建阵列化的多个实验单元,使其在组成和功能层面上更接近人体真实情况,甚至最终能在一个芯片上模拟人体所有器官,从而为药物研发和医学研究提供更有力的工具。
参考文献:
(滑动查看全部)
1. Hamon, M.; Hong, J. W., New tools and new biology: Recent miniaturized systems for molecular and cellular biology. Molecules and Cells 2013, 36 (6), 485-506.
2. Reardon, S., 'Organs-on-chips' go mainstream. Nature 2015, 523 (7560), 266-266.
3. Ingber, D. E., Developmentally inspired human 'organs on chips'. Development 2018, 145 (16).
4. Herland, A.; Maoz, B.; Das, D.; Somayaji, M. R.; Prantil-Baun, R.; Novak, R.; Cronce, M.; Huffstater, T.; Jeanty, S. S. F.; Ingram, M.; Chalkiadaki, A.; Chou, D. B.; Marquez, S.; Delahanty, A.; Jalili-Firoozinezhad, S.; Milton, Y.; Sontheimer-Phelps, A.; Swenor, B.; Levy, O.; Parker, K. K.; Przekwas, A.; Ingber, D. E., Quantitative prediction of human pharmacokinetic responses to drugs via fluidically coupled vascularized organ chips. Nature Biomedical Engineering.
5. Bhatia, S. N.; Ingber, D. E., Microfluidic organs-on-chips. Nature Biotechnology 2014, 32 (8), 760-772.
6. An, F.; Qu, Y. Y.; Luo, Y.; Fang, N.; Liu, Y.; Gao, Z. G.; Zhao, W. J.; Lin, B. C., A Laminated Microfluidic Device for Comprehensive Preclinical Testing in the Drug ADME Process. Scientific Reports 2016, 6.
7. Maschmeyer, I.; Lorenz, A.; Ramme, A.; Hasenberg, T.; Schimek, K.; Hubner, J.; Lauster, R.; Marx, U., A microfluidic four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents. Toxicology Letters 2015, 238 (2), S176-S176.
8. Miller, P. G.; Shuler, M. L., Design and Demonstration of a Pumpless 14 Compartment Microphysiological System. Biotechnology and Bioengineering 2016, 113 (10), 2213-2227.
9. Kim, H. J.; Huh, D.; Hamilton, G.; Ingber, D. E., Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip 2012, 12 (12), 2165-2174.
10. Kim, H. J.; Li, H.; Collins, J. J.; Ingber, D. E., Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America 2016, 113 (1), E7-E15.
11. Sontheimer-Phelps, A.; Chou, D. B.; Tovaglieri, A.; Ferrante, T. C.; Duckworth, T.; Fadel, C.; Frismantas, V.; Sutherland, A. D.; Jalili-Firoozinezhad, S.; Kasendra, M.; Stas, E.; Weaver, J. C.; Richmond, C. A.; Levy, O.; Prantil-Baun, R.; Breault, D. T.; Ingber, D. E., Human Colon-on-a-Chip Enables Continuous In Vitro Analysis of Colon Mucus Layer Accumulation and Physiology. Cellular and Molecular Gastroenterology and Hepatology 2020, 9 (3), 507-526.
12. Kasendra, M.; Tovaglieri, A.; Sontheimer-Phelps, A.; Jalili-Firoozinezhad, S.; Bein, A.; Chalkiadaki, A.; Scholl, W.; Zhang, C.; Rickner, H.; Richmond, C. A.; Li, H.; Breault, D. T.; Ingber, D. E., Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports 2018, 8.
13. Bein, A.; Shin, W.; Jalili-Firoozinezhad, S.; Park, M. H.; Sontheimer-Phelps, A.; Tovaglieri, A.; Chalkiadaki, A.; Kim, H. J.; Ingber, D. E., Microfluidic Organ-on-a-Chip Models of Human Intestine. Cellular and Molecular Gastroenterology and Hepatology 2018, 5 (4), 659-668.
14. Tovaglieri, A.; Sontheimer-Phelps, A.; Geirnaert, A.; Prantil-Baun, R.; Camacho, D. M.; Chou, D. B.; Jalili-Firoozinezhad, S.; de Wouters, T.; Kasendra, M.; Super, M.; Cartwright, M. J.; Richmond, C. A.; Breault, D. T.; Lacroix, C.; Ingber, D. E., Species-specific enhancement of enterohemorrhagic E-coli pathogenesis mediated by microbiome metabolites. Microbiome 2019, 7.
15. Liang, D.; Su, W. T.; Tan, M. Q., Advances of microfluidic intestine-on-a-chip for analyzing anti-inflammation of food. Critical Reviews in Food Science and Nutrition 2022, 62 (16), 4418-4434.
16. Hattori, N.; Yamashiro, Y., The Gut-Brain Axis. Annals of Nutrition and Metabolism 2021, 77, 1-3.
17. Trapecar, M.; Wogram, E.; Svoboda, D.; Communal, C.; Omer, A.; Lungjangwa, T.; Sphabmixay, P.; Velazquez, J.; Schneider, K.; Wright, C. W.; Mildrum, S.; Hendricks, A.; Levine, S.; Muffat, J.; Lee, M. J.; Lauffenburger, D. A.; Trumper, D.; Jaenisch, R.; Griffith, L. G., Human physiomimetic model integrating microphysiological systems of the gut, liver, and brain for studies of neurodegenerative diseases. Science Advances 2021, 7 (5).
18. Mahajan, G.; Doherty, E.; To, T.; Sutherland, A.; Grant, J.; Junaid, A.; Gulati, A.; LoGrande, N.; Izadifar, Z.; Timilsina, S. S.; Horvath, V.; Plebani, R.; France, M.; Hood-Pishchany, I.; Rakoff-Nahoum, S.; Kwon, D. S.; Goyal, G.; Prantil-Baun, R.; Ravel, J.; Ingber, D. E., Vaginal microbiome-host interactions modeled in a human vagina-on-a-chip. Microbiome 2022, 10 (1).
19. Mahdavi, M.; Laforest-Lapointe, I.; Masse, E., Preventing Colorectal Cancer through Prebiotics. Microorganisms 2021, 9 (6).
20. Yau, T. O., Precision treatment in colorectal cancer: Now and the future. Jgh Open 2019, 3 (5), 361-369.
21. Begley, C. G.; Ellis, L. M., Raise standards for preclinical cancer research. Nature 2012, 483 (7391), 531-533.
22. Sokol, E. S.; Miller, D. H.; Breggia, A.; Spencer, K. C.; Arendt, L. M.; Gupta, P. B., Growth of human breast tissues from patient cells in 3D hydrogel scaffolds. Breast Cancer Research 2016, 18.
23. Greenhalgh, K.; Ramiro-Garcia, J.; Heinken, A.; Ullmann, P.; Bintener, T.; Pacheco, M. P.; Baginska, J.; Shah, P.; Frachet, A.; Halder, R.; Fritz, J. V.; Sauter, T.; Thiele, I.; Haan, S.; Letellier, E.; Wilmes, P., Integrated In Vitro and In Silico Modeling Delineates the Molecular Effects of a Synbiotic Regimen on Colorectal-Cancer-Derived Cells. Cell Reports 2019, 27 (5), 1621-+.
24. Albanese, A.; Lam, A. K.; Sykes, E. A.; Rocheleau, J. V.; Chan, W. C. W., Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications 2013, 4.
25. Shuler, M. L., Advances in organ-, body-, and disease-on-a-chip systems. Lab on a Chip 2019, 19 (1), 9-10.


