随着微生物组的发展,活体生物药(也被称为活菌药物)这一市场变得越来越火热,初创公司如雨后春笋不断涌现。那么当前活体生物药市场全球发展态势如何?哪些适应证最为火爆?
今天,我们共同关注活体生物药。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
活体生物药(live biotherapeutic products, LBP),也被称为活菌药物。2016年,美国食品药品监督管理局生物制品评价与研究中心(Food and Drug Administration Center for Biologics Evaluation and Research, FDA/CBER)发布了FDA首个关于活体生物药的指南 “Early Clinical Trials with Live Biotherapeutic Products: Chemistry, Manufacturing, and Control Information”。
该指南指出活体生物药是一类含有具有活性的生物体(如细菌)并可用于预防、治疗或治愈人类疾病或适应证的生物制品,不包括疫苗。同时该指南明确指出了活体生物药特有的研究重点,如株水平的鉴定、菌株的稳定性、菌株的抗生素敏感性和耐药性、菌株移位的可能性、产品的生产控制与稳定性等。
然而,实际上,在“活体生物药”这一概念出来之前,我国就已有类似的产品与概念。在《中国药典》(2015年版)中,专门有章节论述了“微生态活菌制品”,并指出微生态活菌制品系“由人体内正常菌群成员或具有促进正常菌群生长和活性作用的无害外籍细菌,经培养、收集菌体、干燥成菌粉后,加入适宜辅料混合制成,用于预防和治疗因菌群失调引起的相关症状和疾病”。
此外,药典还强调了微生态活菌制品必须由非致病的活细菌组成,在生产过程、制品贮存和使用期间均应保持稳定的活菌状态。同时,药典还明确该制品可由一株、多株或几种细菌制成单价或多价联合制剂,并可以根据其使用途径和方法的不同,制备成片剂、胶囊剂、颗粒剂或散剂等多剂型。
目前,我们可以根据使用的活性生物体的数量和性质将活体生物药分为单菌药物、复合菌药物、工程菌药物3类(表1)。
根据热心肠研究院《肠道产业》数据库数据,据不完全统计,全球至少有65家活体生物药企业,其中美国数量位居第一,中国位居第二(图1)。中国的活体生物药企业包括未知君、知易生物、慕恩生物、厌氧生物、零一生物、优信合生、善泰健康、欧赛微科(OSEL设立于中国的企业)、瀚微生物、普瑞森生物等。此外,韩国、法国和澳大利亚也有多家活体生物药公司,如韩国Genome&Co、法国MaaT Pharma等。

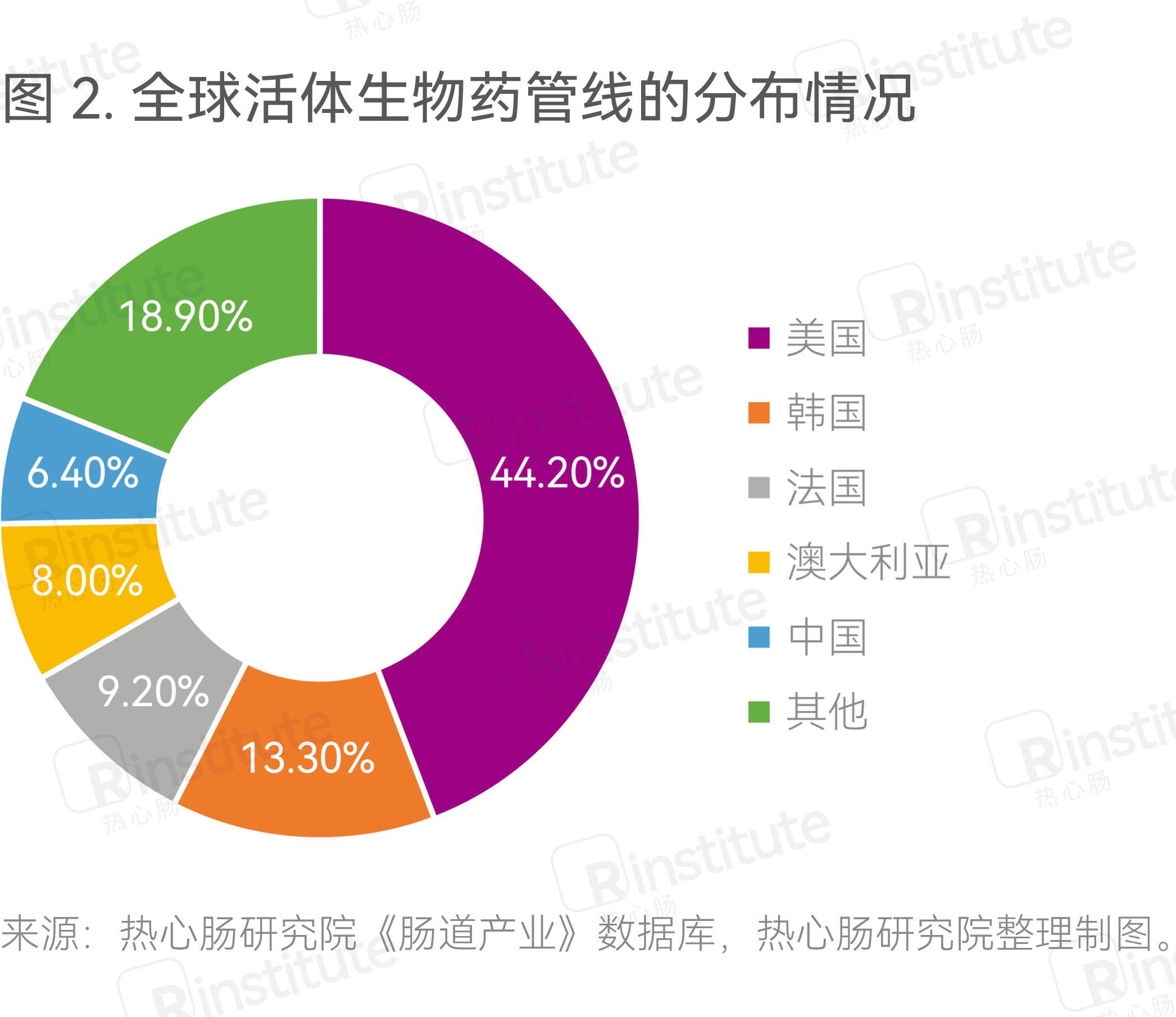
在活体生物药管线方面,据不完全统计,全球现有相关管线259条。美国企业占据大头,其次为韩国、法国(图2)。中国尽管在企业数量上相对较多,但是国内企业基本都选择将研发力量和资金集中于有限的管线上,或者由于公司目前处于初期阶段,尚未披露具体的研发管线,因此在管线数量上相对较少。考虑到前期研发的难度,也有国内活体生物药企业通过收购,拓宽管线和适应证范围,如2022年未知君收购了Assembly公司治疗炎症性肠病的候选药物M201。
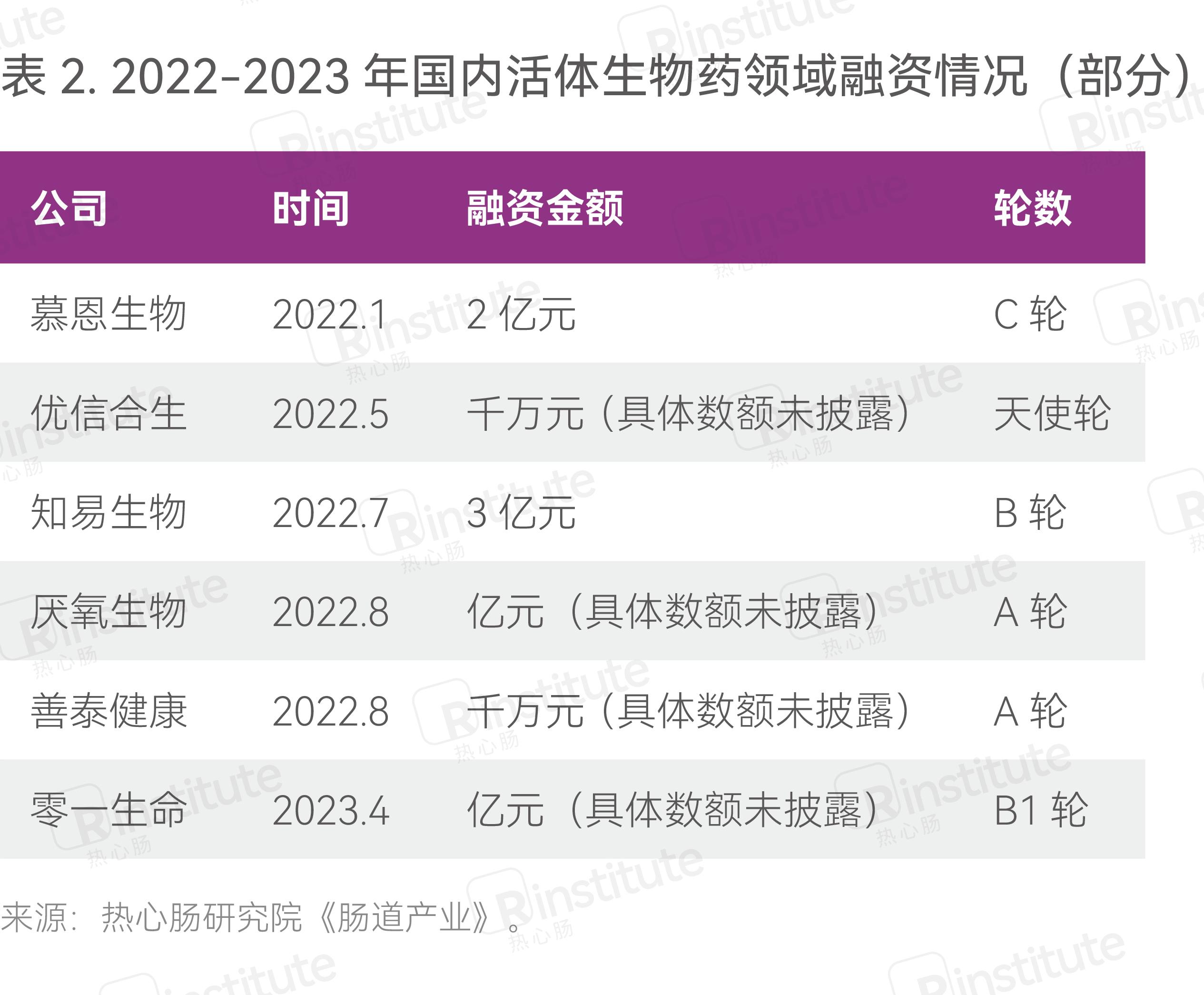
近年来,随着微生物组研究的不断深入,活体生物药领域受到越来越多的关注。过去2年,国内企业融资不断,2022年多家企业获得巨额融资。如慕恩生物、知易生物、厌氧生物、零一生命等企业均获得了亿元投资(表2)。此外,多家益生菌行业龙头和医药企业纷纷布局活体生物药行业,如科拓生物、上药信谊等企业,彰显出中国活体生物药行业蓬勃发展的态势。
在研发上,国内企业也突破连连。2022年7月,上药信谊活体生物药WST01的pre IND申请获得FDA受理。同年8月,君拓生物KEX02活菌制剂联合PD-1抑制剂治疗非小细胞肺癌的药物管线正式获得美国FDA的IND,可进入临床阶段。2023年4月,苏州普瑞森生物科技有限公司自主研发的活菌胶囊PRS217的1期临床试验申请(IND)获得FDA批准。近期,知易生物旗下活体生物药SK10的1期临床研究在美通过伦理会审批,即将迎来首例志愿者入组。
尽管中国活体生物药领域一片向好,但是从全球范围来看,受到疫情等因素影响,多家微生物组公司临床试验进展受阻,资金流受困。
2022年, Finch Therapeutics公司治疗艰难梭菌感染CP101管线的3期试验受到疫情影响被FDA要求暂停;武田终止与Finch公司在炎症性肠病活体生物药上的开发合作。受到上述多重不利因素影响,Finch公司在2023年年初宣布裁员95%并终止CP101的3期临床试验。
此外,2022年另外2家明星微生物组企业也遭受严重打击,4D Pharma从纳斯达克退市,明星公司Kaleido Biosciences黯然关门,十几亿投资灰飞烟灭。尽管在微生物组科学的热潮下,活体生物药行业整体大步前进,但是对于企业个体而言,由于处于发展初期,且活体生物药仍存在诸多不确性,市场态度与企业管线发展情况密切相关,所以发展仍步步维艰。
在活体生物药企业之外,许多全球大型药企(如武田、默沙东、辉瑞和葛兰素史克)通过合作或投资的方式布局活体生物药领域。近年,亦有一些益生菌食品企业开始加入这一赛道。
2020年,IFF与MRM Health联手研发用于2型糖尿病的活体生物药,并于2022年12月取得临床前里程碑。2021年年末,科拓生物宣布与华润江中联合进行肠易激综合征、炎症性肠病用途的活体生物药合作开发项目。2022年8月,科拓生物与未知君合资子公司君拓生物活菌制剂肿瘤管线KEX02获美FDA临床批准。
尽管活体生物药的监管采用与传统生物药类似的体系,但是其研发过程与传统生物药存在明显差异。活体生物药的有效成分并非蛋白质、核酸、糖类等物质,而是具有活性的菌株,因此益生菌食品企业尤其是上游的菌株生产企业具有先天优势,其加入或可加速活体生物药领域的发展。
过去一年,活体生物药行业迎来了一波小丰收。2022年11月,BiomeBank旗下BIOMICTRA获得澳大利亚医疗用品管理局的正式批准,成为全球首个获批的经供体筛选获得的活菌药物。2022年12月,Ferring Pharmaceuticals公司宣布,美国FDA批准了其基于粪菌的活体生物药REBYOTA(RBX2660)。随着这一消息的公布,Ferring Pharmaceuticals与Seres Therapeutics公司之间的竞赛也落下帷幕,REBYOTA成为首款获得FDA批准的微生物组疗法。
REBYOTA旨在预防18岁以上的艰难梭菌感染(CDI)成人病患在接受抗生素治疗后的复发感染,其由符合资格捐赠者的粪便制成,并通过直肠给药。REBYOTA药物的安全性和有效性在五项参与者累计超过1000人的临床试验中得到了验证。两项临床试验的综合分析显示,Rebyota可以有效避免患者CDI复发。具体地,Rebyota组患者成功避免CDI复发的比率为70.6%,显著优于安慰剂组的57.5%。
在REBYOTA获批后不久,2023年4月,Seres Therapeutics旗下用于预防CDI复发的口服活体生物药VOWST(SER-109)成功获得FDA的批准,成为FDA批准的首款口服活体生物药。
此外,值得一提的是Vedanta Biosciences旗下含有8种细菌的候选药物VE303,其预防复发CDI的3期临床试验也预计在2023年启动。
尽管活体生物药在治疗艰难梭菌感染上取得了不错的成绩,但是在其他适应证方面尚未获得令人信服与满意的数据。
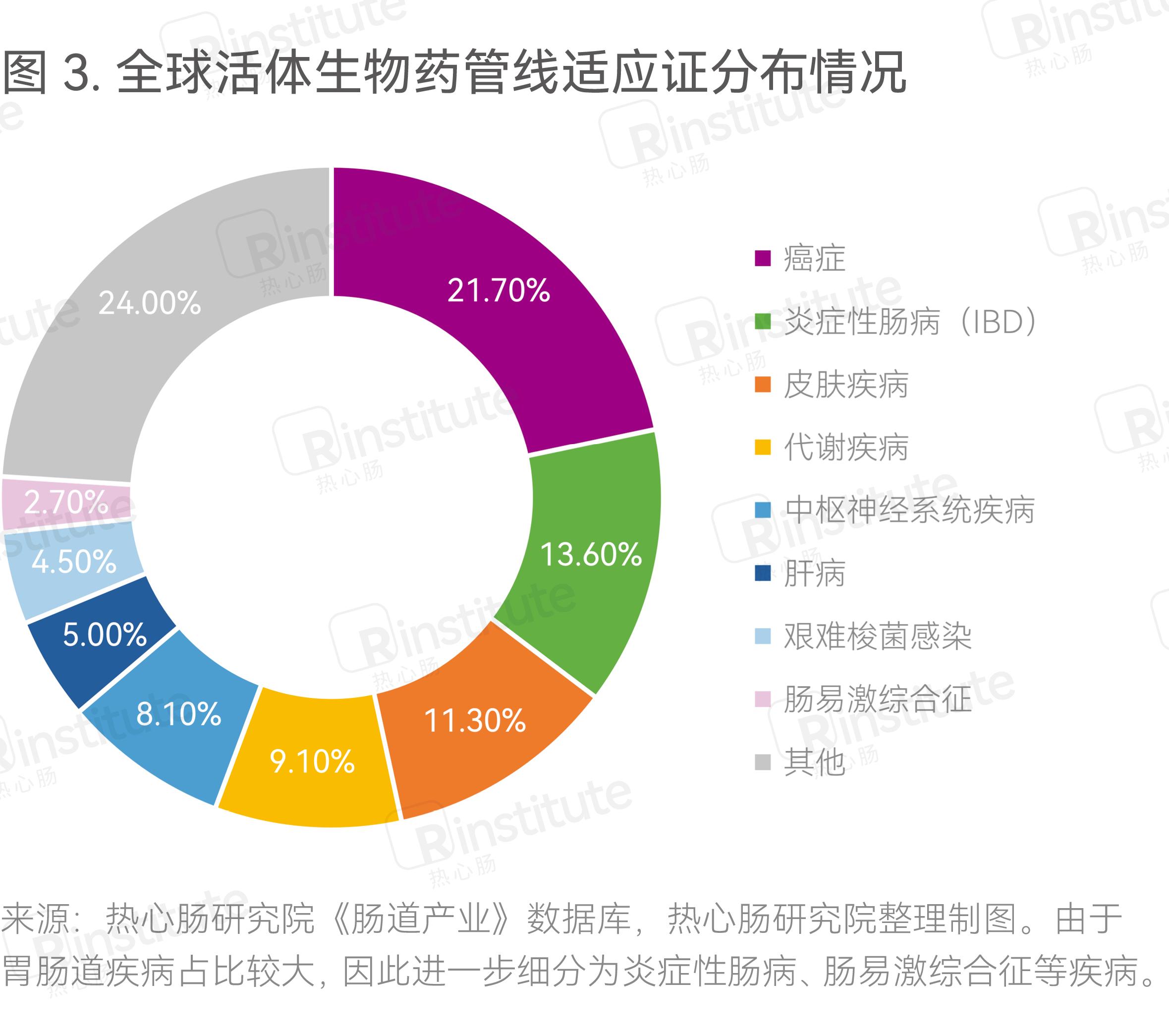
根据热心肠研究院《肠道产业》数据库的数据,癌症是当前活体生物药布局最多的适应证,其次为炎症性肠病、皮肤疾病(主要为特异性皮炎)、代谢疾病(主要为肥胖/糖尿病)、中枢神经系统疾病(图3)。
由此可见,利用微生物辅助抗癌是当前活体生物药最为热门的方向,也是竞争最为激烈的方向。因此也有一些初创公司果断放弃了某些竞争过于激烈的管线。如2022年,韩国知名活体生物药公司Genome&Co公司在评估市面上实体瘤新药研发竞争状况后,选择终止候选药物GEN-001在治疗实体瘤上的1b期临床试验,并集中资源开展该药物在治疗胃癌和胆管癌上的2期临床项目。
除了上述疾病,移植物抗宿主病(GvHD)也值得大家关注。2023年4月,FDA已同意MaaT Pharma公司旗下MaaT013药物开展3期临床研究,作为三线疗法治疗胃肠道急性移植物抗宿主病。
2019年,发表在Nature Medicine杂志上的一篇文章引起轩然大波,该研究发现,补充嗜黏蛋白阿克曼菌(Akk菌)能够改善肥胖患者的代谢,并且死菌效果明显,而补充活菌的益处总体上不显著。
随后,一系列研究开始探究死菌以及微生物不同产物的效果。2022年,有多项研究发现了微生物代谢产物、细菌囊泡、脂多糖等成分可能具有治疗疾病的作用。如,南方医科大学珠江医院周宏伟和何肖龙团队在Cell Host and Microbe杂志上发表的研究发现肠道菌群表达的一种肽聚糖水解酶——DL-endopeptidase(DL-内肽酶)或能缓解克罗恩病。
由于后生元类产品相比于活菌药物更容易生产,稳定性更高,因此当前产业端已有企业开始积极布局。Evelo Biosciences旗下核心候选药物EDP1815由灭活的组织普雷沃氏菌组成,用于治疗皮肤疾病。2022年3月,该公司公布了EDP1815治疗轻中度斑块型银屑病2期临床试验EDP1815-201研究的积极结果。
不过该候选药物的另一个适应证——特异性皮炎的进展并不顺利,2期试验4个队列全部未达到主要评价终点。综合多项临床试验结果,Evelo公司最终决定放弃EDP1815管线,全力投入到治疗银屑病的候选药物EDP2939的研发。EDP2939是一款基于细胞外囊泡的候选药物,临床前研究显示出比EDP1815更强的活性,具有良好研究前景。
在我国,则早已有后生元药品。上世纪70年代,东北农业大学的研究学者从传统酸奶中分离获得嗜酸乳杆菌,结合喷雾干燥技术将菌种发酵物干燥,制成乳酸菌素片。自此,乳酸菌素片逐步发展成为最具代表性的后生元药品。中康开思数据显示,2022年,乳酸菌素品类销售额位居微生态制剂零售渠道第一。
我国有许多企业都布局了乳酸菌素片,如华润江中旗下利活牌乳酸菌素片,定位“肠道日常调理”,适用于腹泻、便秘、肠内异常发酵、肠炎等肠道问题,含蛋白质、多肽、多种游离氨基酸、L-乳酸、多种短链脂肪酸、常量元素、微量元素等。研究表明,乳酸菌素可促进有益菌的繁殖,同时抑制致病菌的生长,具有“养菌”功效。2022年,江中药业发表了多项探究乳酸菌素片治疗缓解腹泻的作用机制的研究,并在积极开展乳酸菌素片缓解肠炎、高脂饮食继发非酒精性脂肪肝等疾病的研究。
尽管当前活体生物药尚未突破艰难梭菌感染这一适应证,但是相信随着微生物组研究的不断深入,我们将能够精确解析出肠道菌群与疾病和健康之间的复杂关系,并寻找到具有治疗作用的关键菌株,从而开发出更多有效的活体生物药。此外,随着技术的不断发展,未来有望解析出关键微生物的作用机制,鉴定出发挥治疗作用的关键物质,并由此开发出更多后生元药物。
任何一类药物的研发初期都将面临巨大的挑战,但是微生态药物的未来依然值得我们期待。


