肠-脑轴已经成为肠道科学的一个重要研究方向。越来越多的研究证明了肠-脑之间存在着复杂的通讯机制。2022年,一系列的研究帮助我们加深了对肠-脑间通讯机制的认识。
今天,我们特别编译发表在Nature Reviews Gastroenterology & Hepatology杂志上关于肠脑轴的年度回顾文章。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
关键要点:
各种途径表明肠道和大脑之间能够进行交流。2022年发表的一系列相关文章表明,我们对肠道和大脑之间多种通路的理解正在迅速加深。
随着研究的不断深入,我们越来越意识到肠道和大脑之间的沟通对健康的重要性,这一点在2016年罗马基金会发布的罗马IV诊断标准中得到了强调,以前被称为功能性胃肠病的疾病被重新命名为肠-脑互动异常疾病1。
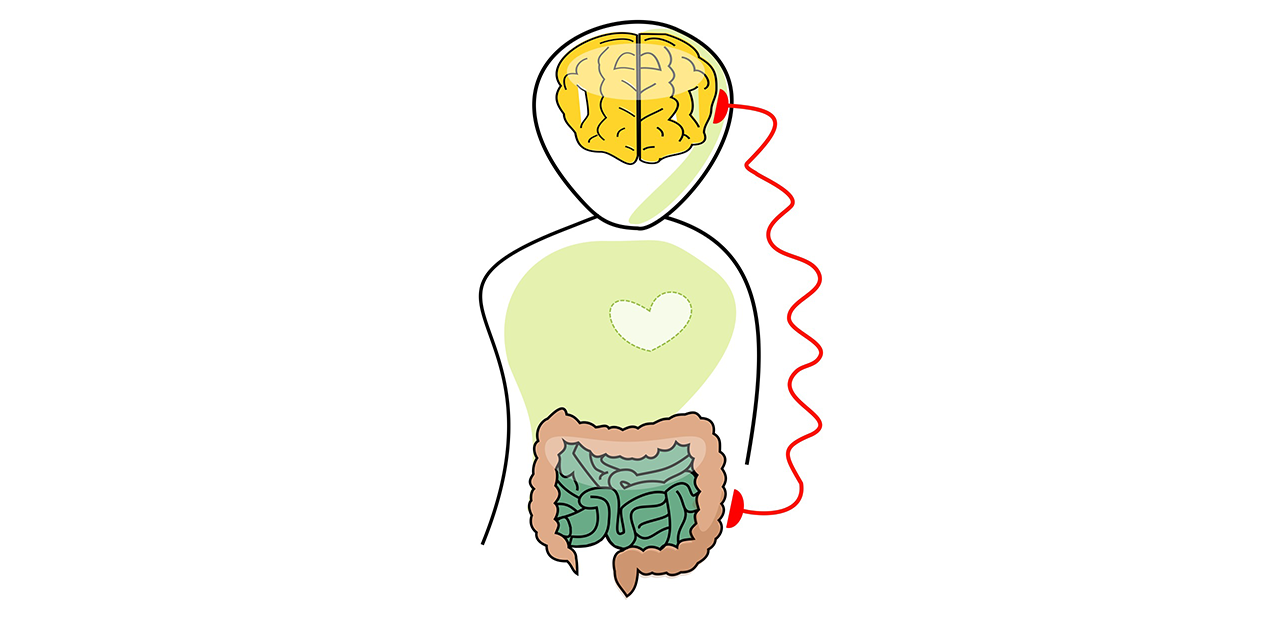
同时,我们对肠-脑轴涉及的多种不同通讯途径(图1)也已经越来越清楚。对这些途径的理解是一个正在蓬勃发展的研究领域。
2022年发表的许多研究探究了肠道和大脑之间双向沟通途径的作用。回顾过去一年,我们将重点关注其中的三项研究,它们展示了不同的肠-脑互作方式,包括迷走神经通路2、内分泌因子3和肠道病毒组的影响4,同时也体现了我们对这些相互作用的理解。

图1. 肠道和大脑间的多种交流机制。肠道(左)渗透压和水摄入量的变化通过迷走神经传递给大脑,而迷走神经则受到局部血管活性肠肽(VIP)释放的刺激。VIP可能来自肠神经系统(ENS)。细菌代谢产物(中)可以穿过肠道上皮,与ENS和中枢神经末梢(包括迷走神经)进行交流。此外,肠内分泌细胞(右)释放的激素和神经肽可以进入体循环,并到达中枢神经系统(CNS)。肠道(上)中的营养物质与细菌、真菌、病毒等微生物的平衡调节着CNS的最终行为变化。
第一项研究是由Ichiki等人发表的,该研究关注了肠道和大脑之间的直接神经联系2。主要涉及以下几种通路机制:与结状神经节上的胞体相连的迷走传入神经具有连接外周和脑干的双向投射作用;背根神经节中的感觉神经元可以投射到肠道和脊髓;迷走神经和交感神经的传出纤维可以与肠道中的靶细胞进行交流5 。
这些通路可以通过支配肠神经系统(ENS)或直接通过肠道细胞传递信息。例如,肠道上皮肠内分泌细胞中的神经足细胞可以与迷走神经的传入纤维形成突触6。
在该研究中,Ichiki等2研究了迷走神经在渴感和饮水中的作用。迷走神经在营养感知和食欲调节中具有重要作用,并且已有研究表明,迷走神经参与调节水的摄入——迷走神经切除术会破坏正常的水摄入7。然而,关于迷走神经是如何感知渗透压并将这些信息传递到大脑很大程度上是未知的。
Ichikide等2利用小鼠的迷走神经(和大脑神经)的神经元的光学和电学记录表明,口渴及口渴感的消除是由肠道和肝门区(HPA)到参与口渴的前脑区域的信号介导的,这些信号是通过迷走神经传递支配的。
利用钙成像和注水实验,研究者发现,向肠道注水引起的肠道低渗透压可以激活迷走神经中的一类特定神经亚群,而向胃注水无法激活。这类神经元被称为表达速激肽1神经元,其可以投射到HPA并通过该区吸收肠道中的水分。靶向手术和化学性迷走神经切断术证明了HPA在检测渗透压信号并将此信号传递到大脑的过程中是至关重要的。
进一步的研究表明,HPA的迷走传入神经本身并不会感知渗透压的变化,相反,这些反应至少有部分是由摄入水后分泌的血管活性肠肽(VIP)介导的,VIP有可能来自于肠神经元。
这项研究的发现不仅对我们理解口渴和消除口渴感背后的稳态机制具有重要意义,而且对我们理解肠-脑轴紊乱如何影响这一重要的生理功能具有重要意义。两个关键问题是肠道渗透压的变化如何刺激VIP的释放,以及肠道释放的VIP如何刺激HPA的迷走传入神经。该研究突出了迷走神经复杂多样的功能以及迷走神经对内脏的支配在肠-脑交流中的作用。
第二项研究是由Lin等人3完成的,该研究提供了关于内分泌通讯机制的新理解。该研究探究了肠道中的激素和神经肽释放后是如何通过循环系统将信息传递到大脑的。
Lin等3研究了特定食物对果蝇3进食行为和求偶行为的影响。在进食行为和求偶行为之间切换的能力对进化适应度很重要,其使动物能够平衡旨在生存的营养摄入时间和旨在繁殖的寻找配偶时间。
Lin等3的研究表明,当雄性果蝇经历饥饿24小时后,再与雌性果蝇被放置在同一个密室中,饥饿的雌性在求偶之前先会花时间进食,而被喂食即不饥饿的雄性果蝇则会立刻开始求偶行为。但是有趣的是,饥饿的雄性果蝇的行为转换取决于可获得的食物——如果喂食蛋白质,雄性果蝇会转换为求偶行为,但如果喂食蔗糖,则不会发生转化。
进一步的机制研究表明,求偶行为的转变是通过可产生利尿激素31(DH31)的肠内分泌细胞的激活介导的。DH31是一种神经肽,可以由果蝇体内许多不同的细胞合成和分泌,包括神经元。
氨基酸可以激活DH31+肠内分泌细胞,并且在喂食氨基酸后,循环系统中的DH31水平升高。从肠道释放的DH31可以激活大脑中特定的神经元亚群,包括表达DH31受体的神经元。这类神经元还可以产生黑化诱导神经肽。
黑化诱导神经肽是在无脊椎动物中发现的一种神经肽,类似于哺乳动物中的促性腺激素释放激素,产生黑化诱导神经肽的神经元参与果蝇的繁殖行为。利用三光子显微镜,研究者揭示了在DH31+肠内分泌细胞被光激活后,产生黑化诱导神经肽的神经元会发生钙活动,即做出响应。此外,脑中DH31受体的消融会阻止进食行为向求偶行为的转化。对这一通路的识别突出了特定营养物质对神经元活动和行为选择的影响。

最后,第三个研究是由Mayneris-Perxachs等人发表的,探讨了肠道病毒组对行为的影响4。虽然现在普遍认为摄入的食物会影响肠道微生物组的组成,进而影响行为,但肠道微生物组影响肠道和中枢神经系统中的神经元功能的机制尚不清楚。
许多关联研究表明,在不同条件下,肠道微生物组组成会发生变化,但这些变化是如何引发宿主的生理变化和行为的,还难以确定8。细菌以外的肠道微生物,包括真菌9和病毒,在这些过程中的作用也是一个较新的研究领域。人肠道中的病毒数量至少等于细菌数量,并且其中大约90 %是感染细菌而非人体细胞的噬菌体10。
在Mayneris-Perxachs等人的研究中,其发现人类肠道中特定噬菌体的增加与特定细菌种类的丰度相关,并与认知测试的表现相关。比如,肠道中有尾噬菌体目及其中的长尾噬菌体科相对丰度较高的人,其肠道中的乳球菌属、乳杆菌属和链球菌属的细菌相对丰度也较高,并且在执行由中央执行网络处理的任务中表现较好。相反,更高水平的微小噬菌体科与执行功能受损相关。
该研究在小鼠和果蝇体内证明了病毒的重要性。通过对这些模式动物的大脑进行转录组学分析,研究者发现有尾病毒目和长尾噬菌体科的增加与神经基因的表达之间存在关联。这些噬菌体的相对丰度与突触可塑性、神经活动和神经元发育相关基因的表达密切相关。
基于上述结果,研究者提出噬菌体的平衡是饮食和微生物组对肠-脑轴影响的重要附加因素。
回顾过去,我们对肠道病毒组的研究一直是复杂的。但这项研究表明,对病毒基因组测序的进展无疑会提高我们对其贡献的理解。
这三项研究以及2022年发表的其他研究表明,肠道和大脑之间的多种沟通途径是一个新兴的研究领域。技术的进步促使我们对基因组、转录组、蛋白组和代谢组了解的增加,并且,毫无疑问,其将使我们能够识别到更多的肠-脑沟通的机制途径。
随着我们逐渐不再使用候选基因策略,未来的研究很可能从单一分子或途径的作用转移到由许多不同因素导致的平衡改变而引发的生理功能和健康的变化。这种转变很可能会导致一种更全面的研究生理功能的方法,它不仅包括一个感兴趣的细胞或器官,而且包括各种器官与我们的微生物组之间的相互作用。
参考文献:
(滑动查看全部)
1. Drossman, D. A. & Hasler, W. L. Rome IV — functional GI disorders: disorders of gut-braininteraction. Gastroenterology 150, 1257–1261 (2016).
2. Ichiki, T. et al. Sensory representation and detection mechanisms of gut osmolality change. Nature 602, 468–474 (2022).
3. Lin, H.-H. et al. A nutrient-specific gut hormone arbitrates between courtship and feeding.Nature 602, 632–638 (2022).
4. Mayneris-Perxachs, J. et al. Caudovirales bacteriophages are associated with improved executive function and memory in flies, mice, and humans. Cell Host Microbe 30,340–356.e8 (2022).
5. Gershon, M. D. & Margolis, K. G. The gut, its microbiome, and the brain: connections and communications. J. Clin. Invest. 131, e143768 (2021).
6. Buchanan, K. L. et al. The preference for sugar over sweetener depends on a gut sensor cell. Nat. Neurosci. 25, 191–200 (2022).
7. Zimmerman, C. A. et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation.Nature 568, 98–102 (2019).
8. Cryan, J. F. & Mazmanian, S. K. Microbiota-brain axis: context and causality. Science 376,938–939 (2022).
9. Leonardi, I. et al. Mucosal fungi promote gut barrier function and social behavior via type 17 immunity. Cell 185, 831–846.e14 (2022).
10. Cao, Z. et al. The gut virome: a new microbiome component in health and disease.EBioMedicine 81, 104113 (2022).


