
各位老师、同学,大家好!
我是来自清华大学医学院、清华大学免疫学研究所的郭晓欢研究员,跟大家分享“肠ILC3之道”。

ILC,就是天然淋巴样细胞,一种新的免疫细胞亚群。
什么是ILC?顾名思义,天然,是相对于获得性免疫而言。从形态来讲,它属于淋巴样细胞,而不是髓样细胞,表现为核大、胞浆少的免疫细胞状态。
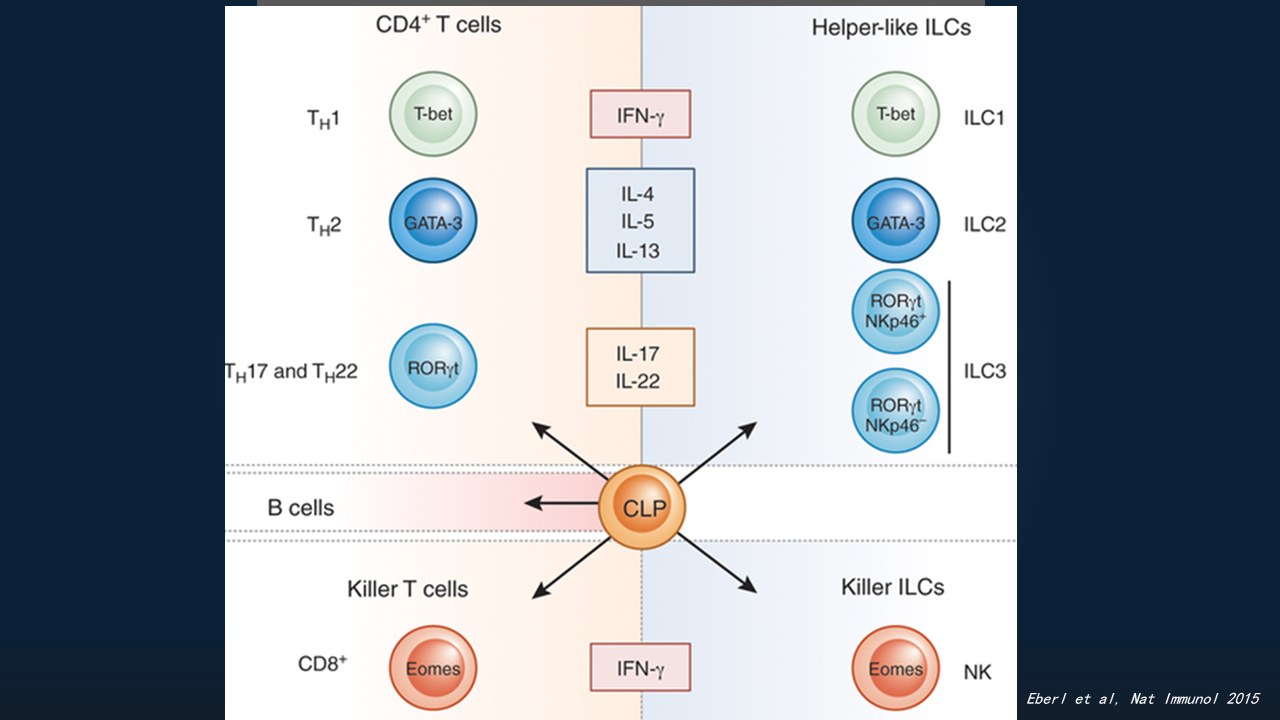
天然淋巴样细胞,其实被发现有多年了。我们都知道,获得性淋巴细胞包括T细胞、B细胞。T细胞,包括CD4+ T细胞、CD8+ T细胞;CD4+ T细胞又包括Th1、Th2、Th17、Treg等多个亚群。
人们陆续发现,在天然免疫细胞里,同样有与T细胞类似,表达类似转录因子、分泌相似细胞因子的一些细胞亚群,当时人们把它叫做固有淋巴细胞1群(ILC1)、固有淋巴细胞2群(ILC2)、固有淋巴细胞3群(ILC3),以及经典的自然杀伤细胞(NK细胞)。
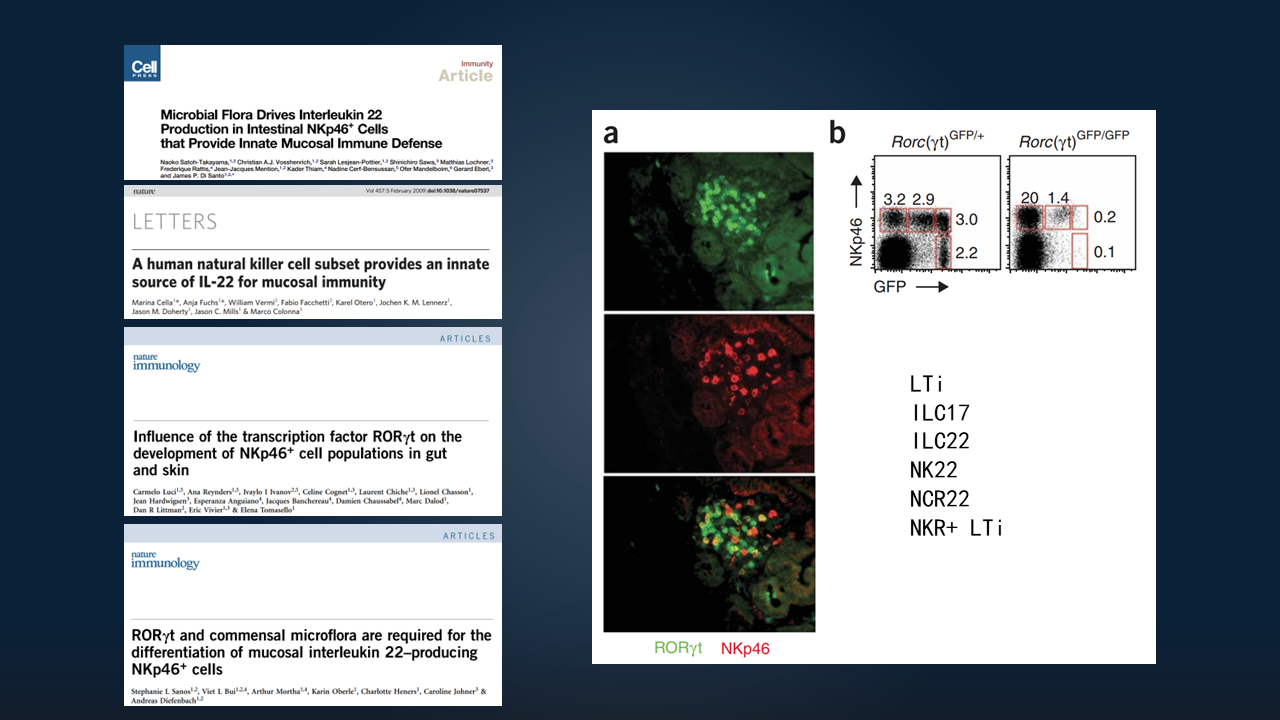
20世纪70年代,人们已经发现NK细胞。20世纪末,人们发现一群CD4+CD3-的淋巴组织诱导细胞(LTi细胞)。直至2008-2009年,陆续发现了表达RORγt、NK细胞受体的一系列细胞,可以表达白细胞介素(IL),如IL-22、IL-17,在肠道黏膜发挥很重要的作用。
我们可以看到,它们在肠道呈聚集形态,表达比较高水平的RORγt,当时被称为LTi类样细胞。其中表达IL-17的细胞叫ILC17,表达IL-22的细胞叫ILC22,表达自然细胞毒性(NCR)受体的细胞叫NCR22或NK22等。
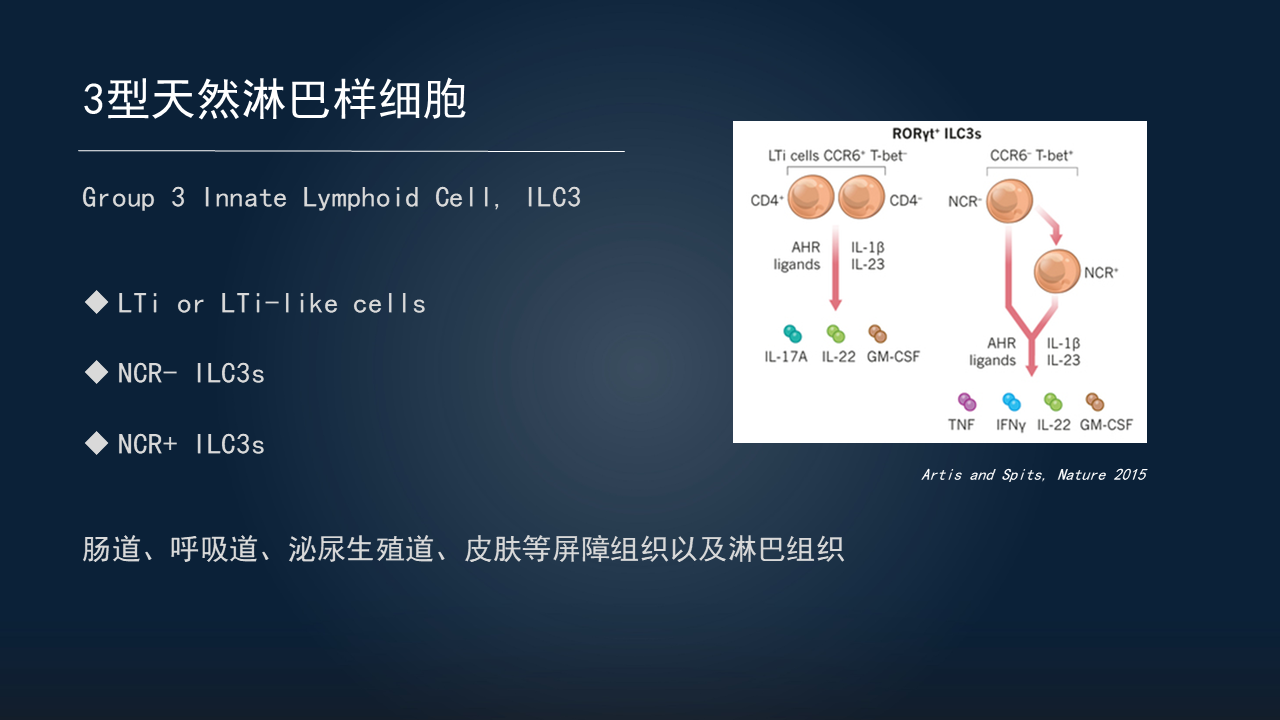
2010年之后,又陆续发现了ILC2、ILC1等一系列亚群。最后,将这群表达RORγt的细胞,统一命名之为ILC3,即3型天然淋巴样细胞,包括3个亚群。
一个亚群是LTi和LTi样细胞。LTi是指出生前的淋巴组织诱导细胞,出生之后由骨髓发育而来的一群细胞,我们称之为LTi样细胞。它们可以高表达趋化因子受体6(CCR6),这对于淋巴组织形成非常重要。
另两个亚群是NCR与NCR+的ILC3,它们可以表达NKp(自然杀伤细胞表面受体)46、NKp44等NK细胞受体,也可以表达分泌IL-22等相关细胞因子,以发挥重要作用。
这些ILC3广泛分布在肠道、呼吸道、泌尿生殖道、皮肤等屏障组织以及淋巴组织。虽然细胞数量非常少,发挥的作用却非常重要。

首先,我们看一下它的发育,看看它从哪来。
ILC3与T细胞、B细胞、其他NK细胞或其他ILC一样,都是从CLP,也就是共同淋巴祖细胞发育而来。
这样的细胞经过分化,可以表达不同的转录调控因子,比如DNA结合抑制剂(Id)和E蛋白。如果高表达Id,它们就向天然淋巴系统分化;如果高表达E蛋白,它们就向获得性T细胞或B细胞分化。
此外,它们会进一步分化为不同的ILC前体细胞,包括最早期分化成NK前体细胞,而后分化为ILC3的一个亚群——LTi前体细胞,变成LTi细胞后再变为ILC前体细胞,最终分化成ILC1、ILC3。
这就是ILC3的发育过程,与其他淋巴细胞一样,都来自于共同淋巴祖细胞。
肠道ILC3作用网络
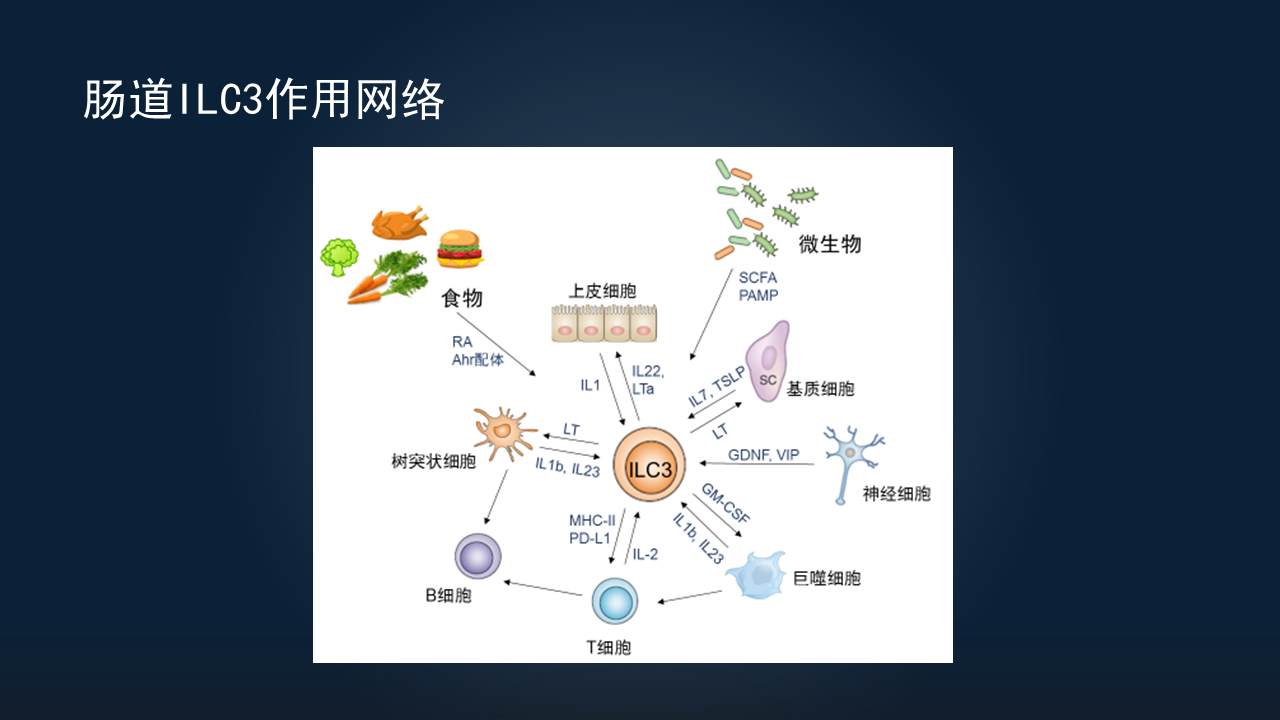
ILC3非常重要,它在体内发挥多种功能,或与很多细胞互作,需要一个网络。
可以看到,它不仅与肠道上皮细胞、基质细胞、天然免疫细胞、树突状细胞、巨噬细胞、获得性T细胞,甚至神经细胞,都有相互作用,很多其他食物成分或微生物也可以影响到ILC。
我简单地介绍一下ILC3与上皮细胞的相互作用。
ILC3可以分泌很多细胞因子,比如IL-10家族重要成分之一的IL-22,主要在上皮细胞表面的IL-22受体高表达,通过激活下游的STAT3信号,影响上皮细胞的功能。它可以通过影响上皮细胞的黏液分子MHCⅡ(主要组织相容性复合体Ⅱ)表达,进而改变紧密连接蛋白表达,同样可以通过IL-22调控抗菌肽的表达。
我们都知道,肠道上皮细胞由肠道干细胞发育而来。研究显示,ILC3对于肠道干细胞具有调控作用。它可以通过IL-22影响肠道干细胞的增殖和分化,也可以促进肠道干细胞的分化与增殖,从而促进肠道稳态或屏障功能。
同样,上皮细胞也可以影响ILC3。上皮细胞可以产生各种促炎性因子,比如IL-1β、IL-1α、IL-17D等,影响到ILC3功能。它可以通过刺激ILC3活化反向作用。
除了上皮细胞外,ILC还可与肠道基质细胞相互作用。最早期,我们发现了ILC3的一个亚群LTi细胞,通过淋巴毒素β(LT-β)与肠道基质细胞发生相互作用。
淋巴毒素与基质细胞表面可表达LT-β受体,促进基质细胞上调很多的趋化因子表达。这些趋化因子可以趋化许多T细胞、B细胞、树突状细胞(DC),然后形成淋巴组织,刺激淋巴组织或后期的三级淋巴组织形成。
除此之外,基质细胞也可以产生一系列的细胞因子促进ILC3的生长,比如IL-7或胸腺基质淋巴生成素(TSLP)。
近期研究还发现:
• ILC3可与树突状细胞或巨噬细胞等天然免疫细胞相互作用,通过产生IL-1、IL-23激活ILC3。反过来,ILC3也可以通过产生淋巴毒素、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等表面活性分子或细胞因子,影响树突状细胞功能。
• ILC3可通过GM-CSF促进巨噬细胞功能。比如IL-10释放、视黄酸表达,从而促进Treg调节性T细胞的发育。
• ILC3,尤其LTi或者LTi样细胞,可高表达经典且重要的抗原呈递分子MHCⅡ,主要在树突状细胞、巨噬细胞或B细胞等专职的抗原呈递细胞表达,可以呈递抗原给CD4+T细胞,从而调控CD4+T细胞的功能。
• ILC3既可表达MHCⅡ而与T细胞受体相互作用,还可表达其他共刺激、共抑制分子,进而调控T细胞的活化或抑制。
前期结果显示,ILC3可以表达MHCⅡ、细胞程序性死亡-配体1(PD-L1),与PD-1+的CD4+的滤泡辅助性T细胞(Tfh)相互作用,抑制Tfh分化,进而影响到抗体生发中心,最终影响到抗体产生。
除此之外,神经系统也可以影响到ILC3。除间接作用外,它可以直接通过产生某些营养因子或是神经递质,调控ILC的功能。
ILC3与其他组分互作
我们知道大部分ILC3分布在肠道,因此除细胞外,肠道里面的其他组分,比如我们吃进去的食物组分,肠道固有的微生物或共生微生物,是可能的病原微生物,都可以调控ILC3的活性。
病原微生物,比如之前研究的比较多的短链脂肪酸,或病原微生物的一些模式分子,都可以通过直接或者间接的方式,影响ILC3的活性。
再比如食物,十字花科食物产生大量芳香烃受体(Ahr)的配体,或者吲哚的一些配体,都可以激活ILC高表达Ahr的活性,促进ILC3的增殖和功能。

还有胡萝卜素,也就是维生素A,或代谢生成的视黄酸,也密切影响ILC3的发育和功能。
前期报道显示,这种作用不仅发生在个体,我们的代际传播也会受到影响。
比如怀孕的母亲,如果摄入足够量的胡萝卜素或维生素A,代谢形成的视黄酸,就可以作用到胎儿,促进胎儿的ILC3发育。如果前期摄入不足,就会造成胎儿的ILC3发育阻滞或延缓,影响到新生鼠或者新生儿的免疫功能。
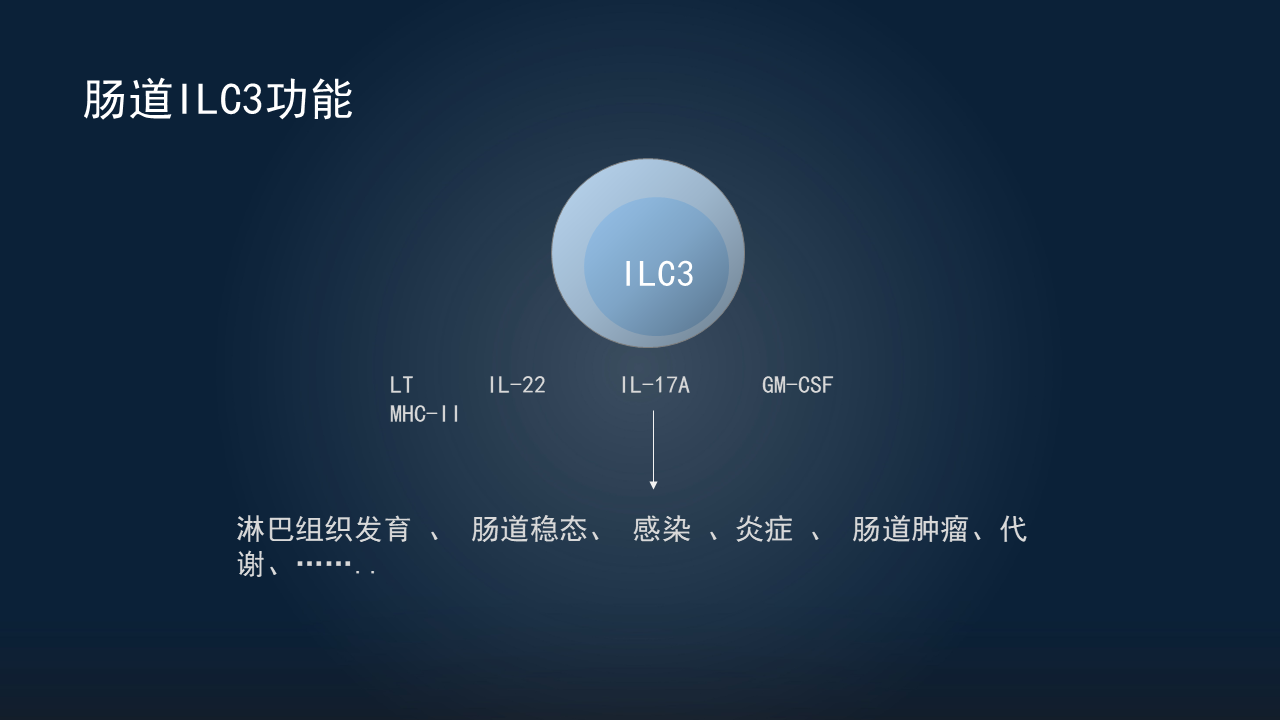
通过前面讲的ILC3作用网络,我们了解到它局限于肠道的一些功能。其实,ILC3在很多组织都有分布,都可发挥它的功能。
ILC3的功能离不开一些效应分子,关键的效应分子,比如淋巴毒素可与基质细胞、树突状细胞表面的LT-β受体相互作用,调控淋巴组织发育或树突状细胞功能;细胞因子IL-22、IL-17,对肠道上皮的功能非常重要;GM-SCF,可以调控髓系细胞;高表达的MHCⅡ,对与T细胞的相互作用非常重要。
所以,ILC3通过这些效应分子,在淋巴组织发育、肠道稳态、感染、炎症、肠道肿瘤以及代谢性疾病等众多方面,都发挥重要的作用。
接下来简单介绍几个ILC3的重要作用。
介导淋巴组织发育

ILC3的一个亚群叫LTi细胞,没有它,我们机体就没有次级淋巴器官,如淋巴结。
图中显示,小鼠有次级淋巴器官,如腹股沟淋巴结和肠系膜淋巴结。但如果把ILC3的重要转录因子RORγt敲除,也就意味着除掉ILC3之后,我们可以看到,它的腹股沟淋巴结、肠系膜淋巴结完全消失了。当然,包括肠道里的派尔集合淋巴结(Peyer patch)或是淋巴滤泡等,也同样消失不见。
再比如右图,Ahr是ILC3的重要转录因子,尤其在出生后,它可以接受食物中的一些代谢产物刺激来维持ILC3的活性。我们可以看到,在正常小鼠,Ahr是完整的,此时肠道有淋巴组织。一旦我们把Ahr敲除掉,等同于清除了ILC3的存在,肠道的淋巴组织就会消失。
没有淋巴组织,我们的免疫反应就会被大幅削弱。一旦受到某些感染性微生物的侵袭,机体功能就很容易受到影响。
维持肠道稳态

再如,ILC3对于维持肠道稳态非常重要。
在静息状态下,或者说初始情况下,ILC3是我们体内IL-22的最主要产生者,所以说此时IL-22的很多作用都是通过ILC3发挥的。
刚才讲到,ILC3可以借由不同机制作用于肠道上皮,通过影响包括紧密连接、黏液蛋白、抗菌肽产生,影响肠道的屏障功能。它还可以影响肠道上皮的糖基化修饰,影响干细胞的分化,影响损伤修复。
这些作用,一方面影响肠道的屏障功能,另一方面影响肠道的微生物变化。
此外,ILC3也可以影响肠道的炎症细胞,比如Th17、Treg。有研究显示,ILC3可以通过这条通路或者下面介绍的通路,影响肠道菌群,再到Th17分化。如果没有ILC3,菌群就会发生失调,就有更多的Th17产生。
最近研究显示,ILC3其实可以直接影响Treg。因为它高表达MHCⅡ和IL-2,促进维持Treg分布,进而维持肠道的稳态。
ILC3还可以通过影响T细胞或者淋巴组织结构,作用于B细胞分泌型抗体IgA的生成,就可以调控肠道菌群,维持菌群稳态。
可见,ILC3通过多种机制都影响肠道微生物的稳态,进而影响体内免疫或炎症的稳态。如果ILC3缺少或者功能破坏,就会影响到这些细胞的变化,影响菌群的变化,最终导致免疫平衡破坏,或者是炎症、感染增加。
因此,ILC3对于肠道稳态非常重要。
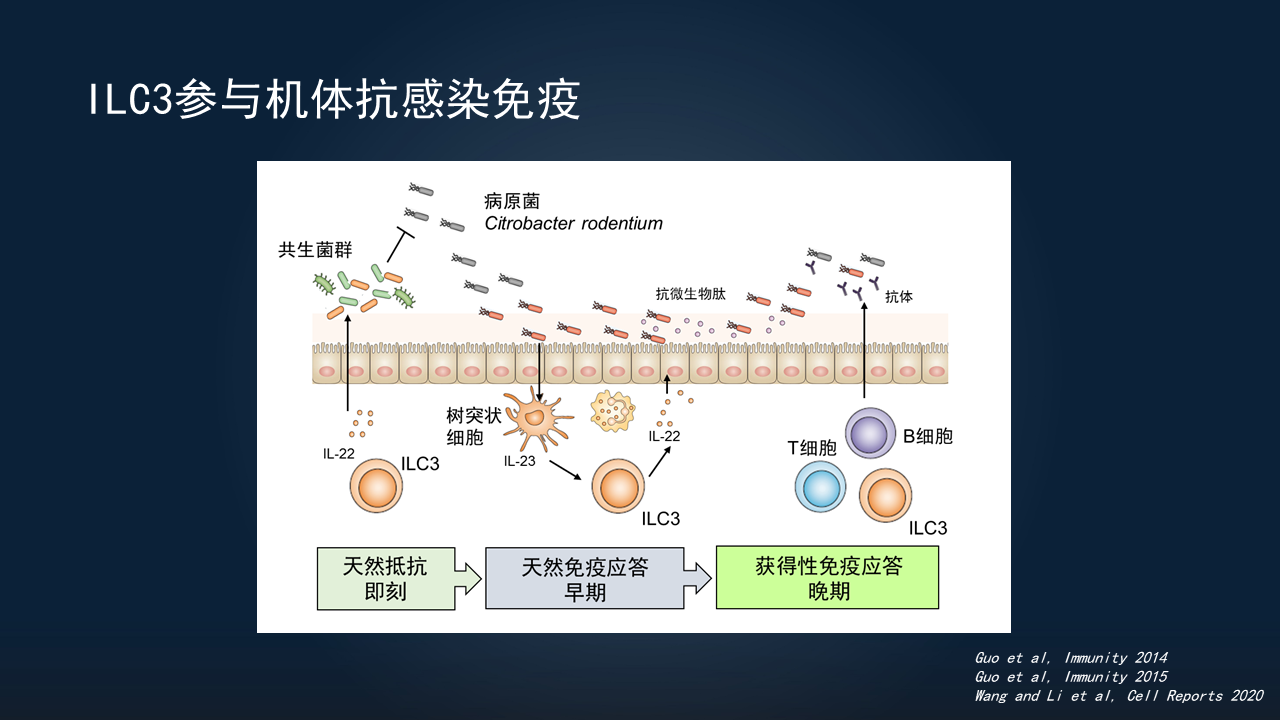
我们实验室在这方面做了很多的工作。
其实机体应对病原微生物的感染,可分为几个阶段。最开始的天然抵抗阶段,是即刻发生的,不需要我们宿主的反应。比如抗菌肽一直在分泌,这些病原微生物进来后立刻会遭遇到它们发挥作用。
如果此阶段没有控制住病原微生物的入侵数量,会进入下一个阶段,就是天然免疫应答阶段。此时,病原微生物可以通过模式分子、代谢物等一系列作用,激活上皮细胞的天然免疫系统,激活树突状细胞、巨噬细胞、B细胞以及天然淋巴样细胞发挥反应。
如果天然免疫应答阶段仍然控制不住,就会进入到后期的获得性免疫阶段。此时,需要T细胞、B细胞产生抗体,帮助我们抵抗病原微生物的感染。
在全部过程中,ILC3都可以发挥作用。
以柠檬酸杆菌Citrobacter感染为例,它是小鼠的一种天然致病菌,与我们人体的大肠杆菌E. coli,尤其肠出血性大肠埃希菌(EHEC)或肠致病性大肠杆菌(EPEC)。
进入小鼠体内后,它可以上调毒力因子表达,贴附于肠道上皮,释放毒力因子,然后影响肠道上皮功能。而我们的机体,可以通过多种途径去抑制它。
最早期的时候,我们实验室发现,在稳态条件下,ILC3可以通过产生IL-22,去维持肠道菌群稳态。稳态的肠道菌群,对于机体抵抗病原微生物定植非常重要。
如果在稳态条件下去除ILC3,就会造成菌群紊乱。病原微生物入侵后,就缺乏共生菌的定植抵抗,它们就可以长驱直入,接触并进入到上皮细胞。
我们实验室还发现,ILC3可以通过程序性死亡受体1(PD-1)、PD-L1、MHCⅡ抑制Tfh反应,控制T细胞应答、B细胞反应,以维持肠道稳态的过程。
所以,ILC3其实参与了机体抗感染免疫的整个阶段。
影响肿瘤进展与疗效
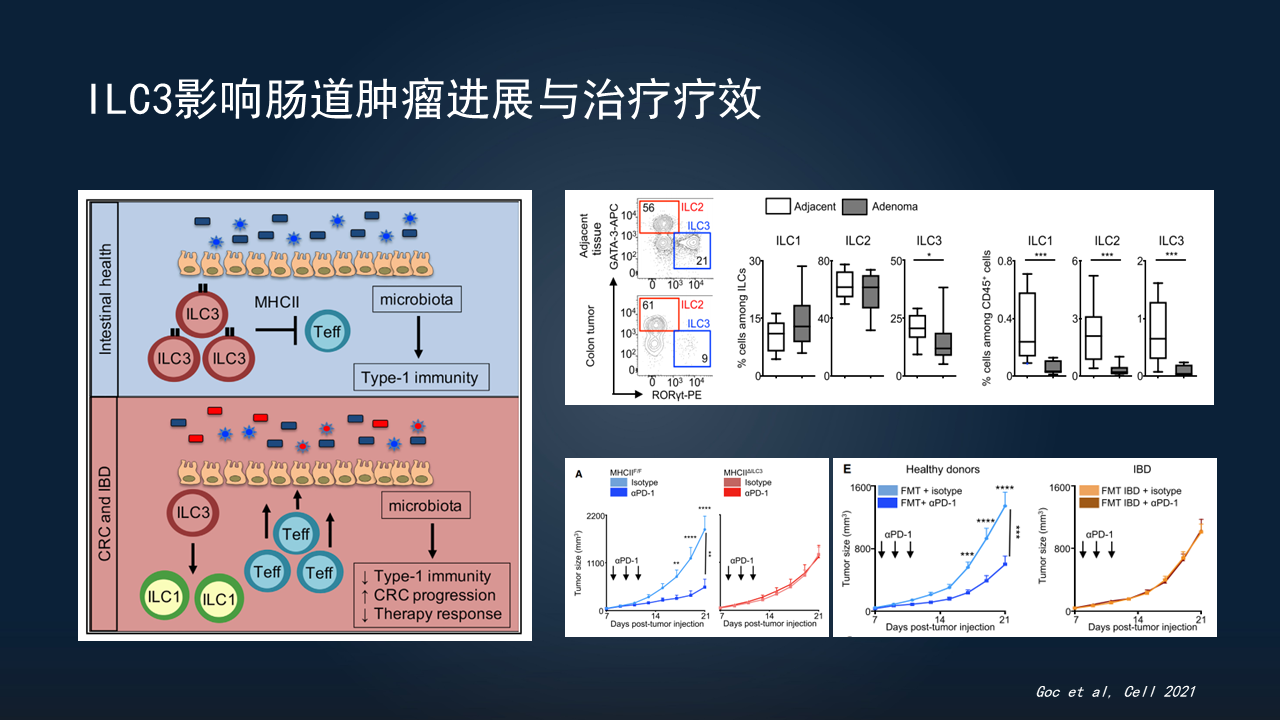
除了抗感染,ILC3还可以影响肠道肿瘤的进展,甚至免疫治疗的疗效。
研究显示,ILC3可表达lL-22,后者可以促进肿瘤细胞生长。研究者还通过病例对照研究发现,癌旁组织有大量的ILC3存在,而癌组织的ILC3数量明显降低。从而提示,ILC3与肠道肿瘤的发生、发展可能呈现负相关关系。
如果在肿瘤发生或肠炎的情况下,ILC3、MHCⅡ或者功能缺陷后,会造成肠道菌群的紊乱。菌群紊乱会导致抗肿瘤的效应T细胞变化,影响肠道肿瘤的进程,以及免疫治疗的疗效。
研究也看到,如果在ILC3功能正常的情况下,PD-1治疗是明显呈现正常的效果。但如果去除ILC3或削弱功能,免疫治疗的效果明显降低,甚至失效。
其实,这个过程是依赖于菌群的。如果把正常菌群移植给小鼠,PD-1的治疗效果能发挥得很好。但如果移植了炎症的菌群,治疗效果明显发生变化。
所以,ILC3在肠道感染、肿瘤、稳态等各种情况下,都发挥很重要的作用。

ILC3还有很多未解之谜,比如ILC3的命运决定信号。目前为止,ILC3是如何发育而来,是受组织信号、食物信号还是菌群信号决定,以及如何启动RORγt表达等,目前仍不清楚。
再比如,ILC3的组织特性调控机制是什么?已有很多研究显示,ILC在不同组织的功能是不一样的。那在不同组织中的作用,是不是受这些特性调控机制所影响,这些都需要很多研究。
最重要的是,在小鼠表现有很重要非冗余作用的ILC3,在人体是否也同样存在一些非冗余的作用。
因为我们知道,人体有很多的天然样淋巴细胞,如NK细胞,或者是骨髓来源的抑制细胞或γδT细胞等T细胞,都发挥很重要的天然免疫作用,都能分泌IL-22、IL-17等重要的细胞因子,它们与ILC3的功能是否属于冗余作用?ILC3是否有其他非冗余作用?这些也需要大家的研究。
当然我们希望,ILC3能够走到临床应用。它到底是否有临床应用价值?如何去应用?现在也是需要解决的重要问题。
以上就是我们实验室的一些研究,我也希望有兴趣的同道能跟我们一起,试图解答或者解决这些问题,这将对人类的健康有很重要的作用。

我的演讲结束了。
谢谢大家!


